
| A. | 铝的金属活动性比铁强,则铝制品比铁制品更易锈蚀 | |
| B. | 水和过氧化氢的组成元素相同,则二者的化学性质相同 | |
| C. | Na+、Mg2+、Cl-的最外层电子数均为8,由此得出离子的最外层电子数均为8 | |
| D. | 同温下分解氯酸钾,加催化剂的反应速率更快,说明催化剂可以改变反应速率 |
分析 A.Al比Fe活泼,但氧化铝是致密是氧化物薄膜而阻止Al进一步被氧化,但Fe的氧化物较疏松,不能阻止Fe被腐蚀;
B.水和过氧化氢是不同物质,化学性质不同;
C.离子的最外层电子数不一定是8;
D.催化剂能改变反应速率,但不影响平衡移动.
解答 解:A.Al比Fe活泼,Al极易被氧化生成氧化铝,氧化铝是致密是氧化物薄膜而阻止Al进一步被氧化,但Fe的氧化物较疏松,不能阻止Fe被腐蚀,所以Fe比Al易被腐蚀,故A错误;
B.水和过氧化氢是不同物质,物质不同导致其化学性质不同,故B错误;
C.离子的最外层电子数不一定是8,如H+核外没有电子,故C错误;
D.同温下分解氯酸钾,加催化剂的反应速率更快,说明催化剂能改变反应速率,但催化剂能同等程度的改变正逆反应速率,所以不影响平衡移动,故D正确;
故选D.
点评 本题考查催化剂、金属性质、离子结构等知识点,为高频考点,侧重考查学生分析判断能力,采用举例法分析解答,注意:催化剂不一定增大反应速率,注意催化剂概念中的关键词“改变化学反应速率”,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(S2-)+c(HS-)+c(H2S)+c(H+)=c(OH-) | B. | c(OH-)=c(HS-)+c(H+)+2 c(H2S) | ||
| C. | c(Na+)=c(S2-)+c(HS-)+c(H2S) | D. | c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该物质属于烃类 | B. | 该物质易溶于水 | ||
| C. | 该物质能使酸性高锰酸钾溶液褪色 | D. | 该物质是一种高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的摩尔质量(g.mol-1)与6.02×1023个磷酸分子的质量(g)在数值上相等 | |
| B. | 6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1 | |
| C. | 32 g氧气所含的原子数目为2NA | |
| D. | 常温常压下,0.5 NA个一氧化碳分子所占体积是11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃,1.01×105 Pa,64g SO2中含有的原子数为3NA | |
| B. | 在1mol的Na2O2晶体中离子总数为3NA | |
| C. | 在0.5mol/L NaCl溶液中,含有的Na+数目为0.5NA | |
| D. | 标准状况下,11.2LH2O 含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
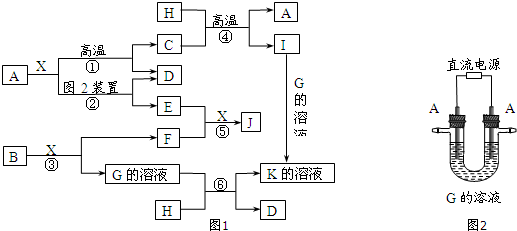
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com