
【题目】三氯化氮(NCl3)是一种消毒剂,可利用氯气与氯化铵溶液反应来制备。已知:三氯化氮的相关性质如下:
物理性质 | 化学性质 |
黄色油状液体,熔点为-40℃,沸点为 71℃,不溶于冷水、易溶于有机溶剂,密度为 1.65 gcm-3 | 95℃时爆炸,热水中发生水解 |
某小组同学选择下列装置(或仪器)设计实验制备三氯化氮并探究其性质:
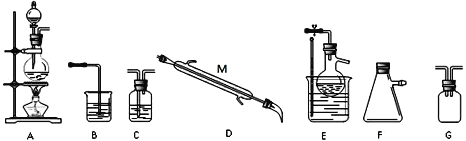
(1)NCl3的电子式为__________________;仪器 M 的名称是______________;
(2)如果气流的方向从左至右,装置连接顺序为A、G、_____________、B。(注明:F仪器使用单孔橡胶塞)
(3)C中试剂是_________________;B装置的作用是________________;
(4)写出E装置中发生反应的化学方程式_______________________________________
(5)当E装置的烧瓶中出现较多油状液体时停止反应。控制水浴加热温度为__________;
(6)已知三氯化氮不具有漂白性,三氯化氮与热水反应的化学方程式为NCl3+4H2O=NH3H2O+3HClO,请设计实验证明该水解反应的产物______________
【答案】![]() 直形冷凝管 C、E、D、F 饱和食盐水 吸收尾气中氯气,避免污染环境 3Cl2+NH4Cl=NCl3+4HCl 71℃~95℃ 用干燥、洁净玻璃棒蘸取三氯化氮液体(F 装置中的黄色油状液体)滴到干燥的
直形冷凝管 C、E、D、F 饱和食盐水 吸收尾气中氯气,避免污染环境 3Cl2+NH4Cl=NCl3+4HCl 71℃~95℃ 用干燥、洁净玻璃棒蘸取三氯化氮液体(F 装置中的黄色油状液体)滴到干燥的
红色石蕊试纸上,试纸不褪色;再滴加数滴热水后,试纸先变蓝色后褪色
【解析】
题干信息显示,利用氯气与氯化铵溶液反应制备三氯化氮,所以制得的氯气不必干燥,但须除去氯化氢,以防干扰三氯化氮的制备。先用A装置制取Cl2,然后经过安全瓶G防止倒吸,再利用C装置除去Cl2中混有的HCl;此时混有少量水蒸气的Cl2进入E装置与蒸馏烧瓶中加入的氯化铵溶液反应,生成三氯化氮和氯化氢;当E装置的烧瓶中出现较多油状液体时停止反应,用水浴加热蒸馏烧瓶,并控制温度在三氯化氮的沸点与95℃(爆炸点)之间,将三氯化氮蒸出,用D冷凝,用F承接;由于Cl2可能有剩余,所以需使用装置B进行尾气处理。
(1)NCl3为共价化合物,N原子与Cl各形成一对共用电子,其电子式为![]() ;仪器 M 的名称是直形冷凝管。答案为:
;仪器 M 的名称是直形冷凝管。答案为:![]() ;直形冷凝管;
;直形冷凝管;
(2)依据分析,如果气流的方向从左至右,装置连接顺序为A、G、C、E、D、F、B。答案为:C、E、D、F;
(3)装置C用于除去Cl2中混有的HCl,所以C中试剂是饱和食盐水;最后所得尾气中可能混有污染环境的Cl2,应除去,由此确定B装置的作用是吸收尾气中氯气,避免污染环境。答案为:饱和食盐水;吸收尾气中氯气,避免污染环境;
(4)E装置中,氯气与氯化铵溶液反应,生成三氯化氮和氯化氢,化学方程式为3Cl2+NH4Cl=NCl3+4HCl。答案为:3Cl2+NH4Cl=NCl3+4HCl;
(5)由以上分析可知,水浴加热温度应控制在三氯化氮的沸点与95℃(爆炸点)之间,应为71℃~95℃。答案为:71℃~95℃;
(6)设计实验时,应能证明现象来自产物,而不是反应物,所以使用的物质应与反应物不反应,但能与两种产物反应,且产生不同的现象,可设计为:用干燥、洁净玻璃棒蘸取三氯化氮液体(F 装置中的黄色油状液体)滴到干燥的红色石蕊试纸上,试纸不褪色;再滴加数滴热水后,试纸先变蓝色后褪色。答案为:用干燥、洁净玻璃棒蘸取三氯化氮液体(F 装置中的黄色油状液体)滴到干燥的红色石蕊试纸上,试纸不褪色;再滴加数滴热水后,试纸先变蓝色后褪色。


科目:高中化学 来源: 题型:
【题目】
镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2-
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数只能为4
D.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“”分别表示出配位键和氢键。_____

(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
![]()
NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
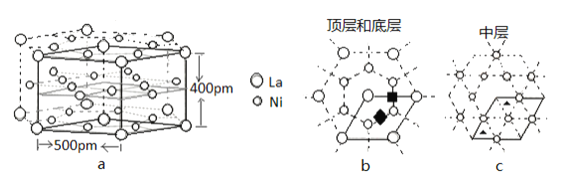
①LaNix合金中x的值为_____;
②晶胞中和“![]() ”同类的八面体空隙有___个,和“
”同类的八面体空隙有___个,和“![]() ”同类的四面体空隙有___个。
”同类的四面体空隙有___个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______g/cm-3(保留2位有效数字,NA=6.0×1023,![]() =1.7)
=1.7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图所示。

已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60~70℃,原因是____________________。
(2)写出“转化”过程中的离子方程式____________________。
(3)“过滤Ⅱ”所得滤液经__________、__________、过滤等操作获得(NH4)2SO4晶体,可用作化学肥料。“过滤Ⅱ”所得滤渣主要成分为CuCl,用乙醇洗涤的优点是________________。
(4)氯化铵用量[![]() ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是__________。
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是__________。

(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:__________。(实验中可选试剂:0.1 mol·L1盐酸、10 mol·L1盐酸、蒸馏水、无水乙醇)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是

A.反应的化学方程式:CO+2H2CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO)=0.075mol/(L·min1)
D.反应至3分钟,用甲醇来表示反应的平均速率为![]() mol/(L·min1)
mol/(L·min1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国学者成功实现用氮气和水生产氨,其装置如下图所示:

下列说法正确的是
A. 上图中的能量转化方式只有2种
B. a极发生的电极反应为N2 + 6H+ + 6e- = 2NH3
C. 装置工作时H+ 向b极区移动,电解质溶液pH减小
D. a极区与b极区产生的气体的物质的量之比为1 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd(OH)2+2Ni(OH)2![]() Cd+2NiOOH+2H2O,有关这个电池的说法正确的是( )
Cd+2NiOOH+2H2O,有关这个电池的说法正确的是( )
A.放电时负极附近的溶液的碱性不变
B.放电时电解质溶液中的OH-向正极移动
C.原电池时的正极反应是:Cd(OH)2+2e-=Cd+OH-
D.原电池时的负极反应是:Cd-2e-+2OH-=Cd(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心。回答下列问题:
(1)乙烷可通过热裂解和氧化裂解制取乙烯。已知下列键能数据:
化学键 | C—C | C=C | C—H | H—H |
键能/ kJ·mol -1 | 347. 7 | 615 | 413. 4 | 436. 0 |
①乙烷直接裂解制乙烯的热化学方程式为_____________________________。
②氧化裂解制乙烯的热化学方程式为C2H6(g) + ![]() O2(g) = C2H4(g) + H2O(g) △H = - 105 kJ·mol-1 . 结合①分析,氧化裂解相对热裂解生产乙烯的优点是:_____________________________________(列举1点)。
O2(g) = C2H4(g) + H2O(g) △H = - 105 kJ·mol-1 . 结合①分析,氧化裂解相对热裂解生产乙烯的优点是:_____________________________________(列举1点)。
(2)利用生物乙醇在某种分子筛催化下可脱水制取乙烯,相应反应如下:
I. C2H5OH(g) ![]() C2H4(g) + H2O(g)
C2H4(g) + H2O(g)
Ⅱ. 2C2H5OH(g) ![]() (C2H5)2O(g) + H2O(g)
(C2H5)2O(g) + H2O(g)
平衡常数[Kp是用平衡分压代替平衡浓度(平衡分压=总压×物质的量分数)]及产品选择性如下图所示:

①反应 C2H5OH(g) ![]() C2H4(g) + H2O(g) 的△H______(填“>”或“<”)0。
C2H4(g) + H2O(g) 的△H______(填“>”或“<”)0。
②关于上图中交点M,下列说法正确的是________(填字母)。
a. 一段时间内,反应I、Ⅱ的速率相等
b. 某温度下,反应I、Ⅱ的平衡常数相等
c. 一段时间内,反应I、Ⅱ中乙醇的转化率相等
(3)利用煤制合成气,再由合成气间接制乙烯包含的反应有:
I. CO(g) +2H2(g) ![]() CH3OH(g) △H=a kJ·mol-1
CH3OH(g) △H=a kJ·mol-1
Ⅱ. 2CH3QH(g) ![]() C2H4(g) + 2H2O(g) △H =b kJ·mol-1
C2H4(g) + 2H2O(g) △H =b kJ·mol-1
①反应 2CO(g) + 4H2(g) ![]() C2H4(g) + 2H2O(g) △H = _________kJ·mol-1 (用 a、b表示)。
C2H4(g) + 2H2O(g) △H = _________kJ·mol-1 (用 a、b表示)。
②在容积为1 L的密闭容器中,投入2 mol CO和4 mol H2,10 min后,测得c(CO) = 1. 2 mol·L-1·min-1,则10 min内v(H2)=_____________ mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物CH3CH3、CH3CH===CH2、CH3CH2C≡CH、CH2===CH2、CH≡CH、![]() 、CH3CH2OH中与甲烷互为同系物的是________,分子空间构型为平面形的是________,直线形的是__________________________。
、CH3CH2OH中与甲烷互为同系物的是________,分子空间构型为平面形的是________,直线形的是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
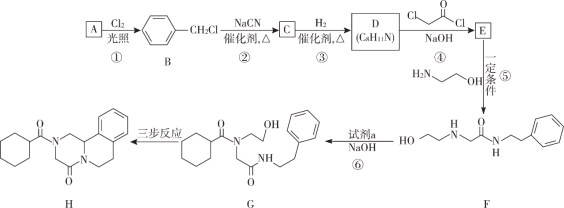
【题目】键线式是表达有机化合物结构的一种方式,如H2N—CH2—CH2—OH 用键线式可以表达为 ![]() 。吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
。吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
已知:I R-Cl+NaCN![]() R-CN+NaCl
R-CN+NaCl
ii 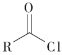 +R′—NH—R"+NaOH
+R′—NH—R"+NaOH![]()
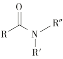 +NaCl+H2O(R、R′表示烃基,R"表示羟基或H)
+NaCl+H2O(R、R′表示烃基,R"表示羟基或H)
(1)A 属于芳香烃,其名称是____________ 。
(2)②的反应类型是_____________ 。
(3)B 的一种同分异构体,含苯环且核磁共振氢谱中出现三组峰,其结构简式为_____________ 。
(4)③中 1 mol C 理论上需要消耗 ___________mol H2 生成 D。
(5)④的化学方程式是_____________ 。
(6) 试剂 a 的结构简式是 ____________________。
(7) G→H 分为三步反应,J 中含有 3 个六元环,写出 I、J 的结构简式________________、__________________。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com