

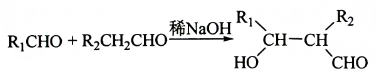
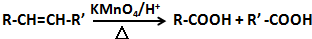
 ��
�� ��
������ ��A����Է�������Ϊ70����$\frac{70}{12}$=5��10����AΪC5H10���˴Ź���������ʾֻ��һ�ֻ�ѧ�������⣬��A�Ľṹ��ʽΪ ��A�������ڹ����·���ȡ����Ӧ���ɵ��ȴ���B����BΪ
��A�������ڹ����·���ȡ����Ӧ���ɵ��ȴ���B����BΪ ��B������ȥ��Ӧ����CΪ
��B������ȥ��Ӧ����CΪ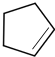 ��������C�ķ���ʽΪC5H8��C����������Ӧ����DΪHOOC��CH2��3COOH��F�Ǹ������ֵ����ʣ���FΪHCHO��E��FΪ��Է���������14��ͬϵ���֪EΪCH3CHO������Ϣ��֪E��F�����ӳɷ�Ӧ����GΪHOCH2CH2CHO��G�����������ӳɷ�Ӧ����HΪHOCH2CH2CH2OH��D��H�������۷�Ӧ����PPG��
��������C�ķ���ʽΪC5H8��C����������Ӧ����DΪHOOC��CH2��3COOH��F�Ǹ������ֵ����ʣ���FΪHCHO��E��FΪ��Է���������14��ͬϵ���֪EΪCH3CHO������Ϣ��֪E��F�����ӳɷ�Ӧ����GΪHOCH2CH2CHO��G�����������ӳɷ�Ӧ����HΪHOCH2CH2CH2OH��D��H�������۷�Ӧ����PPG�� �����ݴ˽��
�����ݴ˽��
��� �⣺��A����Է�������Ϊ70����$\frac{70}{12}$=5��10����AΪC5H10���˴Ź���������ʾֻ��һ�ֻ�ѧ�������⣬��A�Ľṹ��ʽΪ ��A�������ڹ����·���ȡ����Ӧ���ɵ��ȴ���B����BΪ
��A�������ڹ����·���ȡ����Ӧ���ɵ��ȴ���B����BΪ ��B������ȥ��Ӧ����CΪ
��B������ȥ��Ӧ����CΪ ��������C�ķ���ʽΪC5H8��C����������Ӧ����DΪHOOC��CH2��3COOH��F�Ǹ������ֵ����ʣ���FΪHCHO��E��FΪ��Է���������14��ͬϵ���֪EΪCH3CHO������Ϣ��֪E��F�����ӳɷ�Ӧ����GΪHOCH2CH2CHO��G�����������ӳɷ�Ӧ����HΪHOCH2CH2CH2OH��D��H�������۷�Ӧ����PPG��
��������C�ķ���ʽΪC5H8��C����������Ӧ����DΪHOOC��CH2��3COOH��F�Ǹ������ֵ����ʣ���FΪHCHO��E��FΪ��Է���������14��ͬϵ���֪EΪCH3CHO������Ϣ��֪E��F�����ӳɷ�Ӧ����GΪHOCH2CH2CHO��G�����������ӳɷ�Ӧ����HΪHOCH2CH2CH2OH��D��H�������۷�Ӧ����PPG�� ����
����
��1��ͨ�����Ϸ���֪��A�ṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2��E��F�����ӳɷ�Ӧ����G���ʴ�Ϊ���ӳɷ�Ӧ��
��3��PPG�Ľṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��4��DΪHOOC��CH2��3COOH��D��ͬ���칹���������������
�����뱥��NaHCO3��Һ��Ӧ��������˵�������Ȼ���
�ڼ��ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ��˵������ȩ����������
D�й�5��C����3��C-C-C�ϵ�2��H��-COOH��-OOCHȡ������Ϊ3+2=5�֣�
�ʴ�Ϊ��5��
���� ���⿼���л�����ƶϣ�Ϊ��Ƶ���㣬���պϳ���̼���仯�������ű仯����Ӧ�����ƶ�����Ϊ���Ĺؼ������ط������ƶ��������ۺϿ��飬�ѵ���ͬ���칹�������жϣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

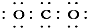

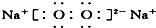
| A�� | �٢ڢۢ� | B�� | �ݢޢߢ� | C�� | �ڢۢݢޢ� | D�� | �٢ܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
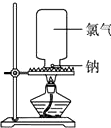 �������ƺ�������Ӧ��ʵ����ƣ�
�������ƺ�������Ӧ��ʵ����ƣ�| ���� | |
| ��ѧ����ʽ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ڵڢ�A���A��Ԫ�ص�ԭ�Ӽ乹�ɵķ��ӣ�������ԭ�������8���ӽṹ | |
| B�� | �����ߵĵ�������˽��������˶��������͵ĵ��������Զ�������˶� | |
| C�� | ����������ụΪͬϵ�� | |
| D�� | ͬһԭ���У�1s��2s��3s�������ɵĵ�����Խ��Խ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H��Cl | B�� | H[��O��]2- H | C�� | Mg2+  2 2 | D�� | Na+ 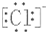 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PH=3�������PH=11�İ�ˮ | B�� | PH=3�������PH=11��Ba��OH��2��Һ | ||
| C�� | PH=3�������PH=11�İ�ˮ | D�� | PH=3�Ĵ����PH=11��Ba��OH��2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������Һ | B�� | �廯����Һ | C�� | ��ˮ | D�� | ��������Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com