
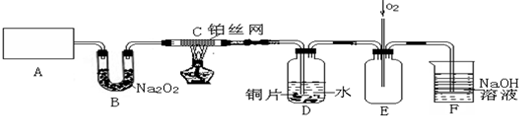
分析 将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯,部分实验的现象如下:铂丝继续保持红热状态说明反应放热,D中的铜片慢慢溶解,说明有硝酸生成溶解铜片,说明A出生成的气体中含有氨气,和过氧化钠反应生成氧气的气体二氧化碳、水蒸气;A中制取气体时是加热氯化铵、氢氧化钙的方法制备氨气,装置E是 通入的氧气好身材的一氧化氮身材二氧化氮进入装置F被氢氧化钠溶液吸收,
(1)实验室用加热氯化铵、氢氧化钙的方法制备氨气;
(2)B装置作用是吸收二氧化碳和水蒸气生成氧气;
(3)放热反应开始后,不需要持续加热;硝酸根离子在酸性环境下具有强的氧化性能够氧化铜,增大氢离子浓度能使Cu片溶解的速率加快,可以加入试剂形成原电池加快反应速率,增大离子浓度加快反应速率;
(4)持续通入氧气使一氧化氮气体全部氧化,被氢氧化钠溶液吸收,减少环境污染;
(5)D装置中的液体易发生倒吸,需要在CD之间加一个防倒吸的装置.
解答 解:(1)加热氯化铵、氢氧化钙生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)B装置是利用过氧化钠吸收碳酸氢钠分解生成的二氧化碳和水蒸气生成氧气,
故答案为:吸收二氧化碳和水蒸气并产生氧气;
(3)撤去C处酒精灯后铂丝能继续保持红热状态,说明该反应为放热反应;
A.Na2CO3 消耗硝酸不能加快铜的反应速率,故A错误;
B.AgNO3 和铜反应生成银,铜和银在稀硝酸溶液中析出原电池加快反应速率,故B正确;
C. H2SO4 会增大氢离子浓度加快铜与稀硝酸的反应速率,故C正确;
D.FeSO4会消耗硝酸,所以不能加快铜的反应速率,故D错误;
故答案为:该反应为放热反应;BC;
(4)持续通入氧气使一氧化氮气体全部氧化,被氢氧化钠溶液吸收,减少环境污染,故答案为:将产生的NO氧化,充分被NaOH溶液吸收;
(5)D装置中的液体易发生倒吸到C装置,需要在CD之间加一个防倒吸的装置,故答案为:CD之间加一个防倒吸的装置.
点评 本题考查了氨气的制备、性质的检验,熟悉氨气制备原理是解题关键,注意实验装置的作用和注意问题,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 草酸二酯的分子式为C26H22Cl6O8 | |
| B. | 1mol草酸二酯与氢氧化钠稀溶液反应时(苯环上卤素不水解),最多消耗6mol NaOH | |
| C. | 草酸二酯酸性条件下水解可以得到两种有机物 | |
| D. | 1mol草酸二酯与氢气完全反应,需要氢气10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氢为2 g | B. | H2O的摩尔质量为18 g | ||
| C. | 44 g CO2的体积为22.4 L | D. | 9.8 g H2SO4含0.1NA个H2SO4分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HClO4>H3PO4>H2SO4 | B. | 原子半径大小:Na>P>N | ||
| C. | 碱性强弱:NaOH>Mg(OH)2>Al(OH)3 | D. | 金属性强弱:K>Na>Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+CuSO4═FeSO4+Cu 氧化性Fe>Cu | |
| B. | Cl2+2KI═2KCl+I2氧化性Cl2>I2 | |
| C. | H2+CuO═Cu+H2O CuO是还原剂 | |
| D. | CaCO3+H2O+CO2═Ca(HCO3)2 是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 失去电子的反应为还原反应 | |
| B. | 含有氧元素的物质是氧化剂 | |
| C. | 氧化剂得到电子的数目和还原剂失去的电子的数目一定相等 | |
| D. | 氧化剂和还原剂不可能是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com