
| A. | “暖冰”中的水分子存在π键 | |
| B. | 水变成“暖冰”,体积会变小 | |
| C. | 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” | |
| D. | -个水分子与其他水分子间只能形成2个氢键 |
分析 A、“暖冰”中的水分子中氧原子含有2个σ键和2个孤对电子;
B、暖冰中氢键比水中多;
C、根据题意知,电场作用下,水分子间更易制得“暖冰”;
D、每个水分子与相邻四个水分子形成四个氢键.
解答 解:A、“暖冰”中的水分子中氧原子含有2个σ键和2个孤对电子,所以不存在π键,故A错误;
B、由于暖冰中氢键比水中多,所以水变成“暖冰”,体积会变大,故B错误;
C、在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”,否则20℃时,水分子不能瞬间凝固形成冰,故C正确;
D、水分子中氧原子含有一对孤对电子,O原子电负性较大,可以和其它的水分子形成两个氢键,含有的两个氢原子,可以分别和其它的水分子的氧原子形成两个氢键,所以以一个水分子为中心的正四面体结构,每个水分子与相邻四个水分子形成四个氢键,故D错误;
故选C.
点评 本题考查了水分子的间作用力及其影响因素等知识点,题目难度不大,注意水分子之间存在氢键,暖冰主要通过氢键形成固体.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
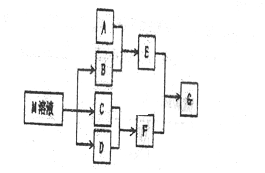
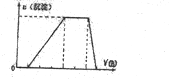
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2C2O4是氧化剂 | |
| B. | KClO3是还原剂 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1molKClO3参加反应有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地沟油经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 | |
| C. | 采用纳米TiO2光触媒技术,可将装修材料中释放的HCHO转化为无害物质 | |
| D. | 神舟十一号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是硅晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
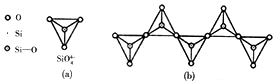
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 只能利用焰色反应可鉴别KCl溶液和Na2SO4溶液 | |
| C. | 用水润湿pH试纸测量某溶液的PH | |
| D. | 实验室用NaOH溶液除去Cl2中的少量HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com