
【题目】工业上由N2、H2合成NH3 . 制备H2需经多步完成,其中“水煤气(CO、H2)变换”是纯化H2的关键一步.
(1)水煤气变换:CO(g)+H2O(g)CO2(g)+H2(g),平衡常数K随温度变化如表:
温度/℃ | 200 | 300 | 400 |
K | 290 | 39 | 11.7 |
①下列分析正确的是 .
a.水煤气变换反应的△H<0
b.增大压强,可以提高CO的平衡转化率
c.增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
②以氨水为吸收剂脱除CO2 . 当其失去吸收能力时,通过加热使吸收剂再生.用化学方程式表示“吸收”、“再生”两个过程: .
(2)Fe3O4是水煤气变换反应的常用催化剂,经CO、H2还原Fe2O3制备.两次实验结果如表:
实验Ⅰ | 实验Ⅱ | |
通入气体 | CO、H2 | CO、H2、H2O(g) |
固体产物 | Fe3O4、Fe | Fe3O4 |
结合化学方程式解释H2O(g)的作用: .
(3)2016年我国某科研团队利用透氧膜,一步即获得N2、H2 , 工作原理如图所示.(空气中N2与O2的物质的量之比按4:1计) 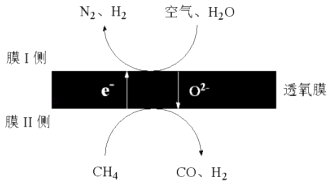
①起还原作用的物质是 .
②膜Ⅰ侧发生的电极反应式是 .
③膜Ⅰ侧所得气体 ![]() =3,CH4、H2O、O2反应的化学方程式是 .
=3,CH4、H2O、O2反应的化学方程式是 .
【答案】
(1)ac;NH3+H2O+CO2=NH4HCO3、NH4HCO3 ![]() NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
(2)Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g),加入H2O(g)后抑制Fe3O4被H2进一步还原
(3)CH4;H2O+2e-=H2+O2﹣、O2+4e-=2O2﹣;14CH4+12H2O+O2=14CO+4OH2 .
【解析】解:(1)①a.由表格数据可知,温度越高,K越小,则正反应为放热反应,则△H<0,故正确;b.该反应为气体体积不变的反应,增大压强,平衡不移动,不能提高转化率,故错误;c.增大水蒸气浓度,反应速率增大,促进CO的转化,则可以同时增大CO的平衡转化率和反应速率,故正确; 所以答案是:a c;②以氨水为吸收剂脱除CO2 . 当其失去吸收能力时,通过加热使吸收剂再生.用化学方程式表示“吸收”、“再生”两个过程吸收:NH3+H2O+CO2=NH4HCO3、NH4HCO3 ![]() NH3↑+H2O+CO2↑,所以答案是:NH3+H2O+CO2=NH4HCO3、NH4HCO3
NH3↑+H2O+CO2↑,所以答案是:NH3+H2O+CO2=NH4HCO3、NH4HCO3 ![]() NH3↑+H2O+CO2↑;(2)发生Fe3O4(s)+4H2(g)3Fe(s)+4H2O(g),增大生成物浓度,平衡逆向移动,则H2O(g)的作用为Fe3O4(s)+4H2(g)3Fe(s)+4H2O(g),加入H2O(g)后抑制Fe3O4被H2进一步还原,所以答案是:Fe3O4(s)+4H2(g)3Fe(s)+4H2O(g),加入H2O(g)后抑制Fe3O4被H2进一步还原;(3)①C失去电子,则起还原作用的物质是CH4 , 所以答案是:CH4;②膜Ⅰ侧发生的电极反应式是H2O+2e﹣=H2+O2﹣、O2+4e﹣=2O2﹣ , 所以答案是:H2O+2e﹣=H2+O2﹣、O2+4e﹣=2O2﹣;③空气中N2与O2的物质的量之比为4:1,膜Ⅰ侧所得气体
NH3↑+H2O+CO2↑;(2)发生Fe3O4(s)+4H2(g)3Fe(s)+4H2O(g),增大生成物浓度,平衡逆向移动,则H2O(g)的作用为Fe3O4(s)+4H2(g)3Fe(s)+4H2O(g),加入H2O(g)后抑制Fe3O4被H2进一步还原,所以答案是:Fe3O4(s)+4H2(g)3Fe(s)+4H2O(g),加入H2O(g)后抑制Fe3O4被H2进一步还原;(3)①C失去电子,则起还原作用的物质是CH4 , 所以答案是:CH4;②膜Ⅰ侧发生的电极反应式是H2O+2e﹣=H2+O2﹣、O2+4e﹣=2O2﹣ , 所以答案是:H2O+2e﹣=H2+O2﹣、O2+4e﹣=2O2﹣;③空气中N2与O2的物质的量之比为4:1,膜Ⅰ侧所得气体 ![]() =3,氮气在反应前后不变,设氮气为4mol,则生成氢气为12mol,由膜I侧反应可知12molH2O得到电子、1molO2得到电子,膜I上发生12H2O+24e﹣=12H2+12O2﹣、O2+4e﹣=2O2﹣ , 膜II上14molCH4中C失去84mol电子、H得到56mol电子时,总反应遵循电子守恒,则反应为14CH4+12H2O+O2=14CO+4OH2 , 所以答案是:14CH4+12H2O+O2=14CO+4OH2 .
=3,氮气在反应前后不变,设氮气为4mol,则生成氢气为12mol,由膜I侧反应可知12molH2O得到电子、1molO2得到电子,膜I上发生12H2O+24e﹣=12H2+12O2﹣、O2+4e﹣=2O2﹣ , 膜II上14molCH4中C失去84mol电子、H得到56mol电子时,总反应遵循电子守恒,则反应为14CH4+12H2O+O2=14CO+4OH2 , 所以答案是:14CH4+12H2O+O2=14CO+4OH2 .
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】资料显示,可用次氯酸钠处理废水中的氨氮(NH3),使其转化为氮气除去,其主要反应如下: ①NH3(aq)+HClO(aq)═NH2Cl(aq)+H2O(l)
②2NH2Cl(aq)+HClO(aq)═N2(g)+H2O(l)+3HCl(aq)
(1)在其他条件不变的情况下,向一定量废水中逐滴滴加次氯酸钠溶液,氨氮去除率随 ![]() 的变化曲线如图1:
的变化曲线如图1: 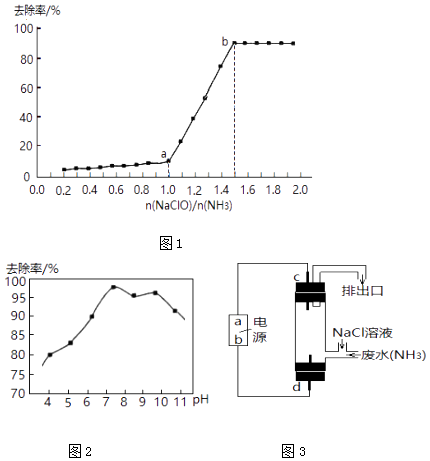
Ⅰ.物质NH2Cl中氮元素的化合价是 .
Ⅱ.a﹣b点间,溶液中氨氮去除率迅速提高的原因是 .
(2)Ⅰ.反应①②中HClO 的来源用化学用语解释是 . Ⅱ.实验测得,废水中pH与氨氮去除率如图2所示:
pH较高时,氨氮去除率下降的原因是 .
pH较低时,氨氮去除率也下降,可能的原因是 .
(3)运用上述原理去除废水中的氨氮,可结合图3所示的电解法. Ⅰ.a极为 .
Ⅱ.d极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与安全事故处理错误的是( )
A.使用水银温度计测量烧杯中的水的温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
B.试管夹从试管底由下往上夹住试管口约 ![]() 处,手持试管夹长柄末端进行加热
处,手持试管夹长柄末端进行加热
C.燃着的酒精灯翻倒,酒精洒到桌面并且燃烧,为了人身安全,应立即撤离现场
D.将玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端并缓慢旋进塞孔中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同,浓度均为0.1mol/L的NaOH溶液、氨水,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为
A. 4m=n B. m=n C. m<n D. m>n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是
A.2 mol·L-1H2SO4溶液B.2 mol·L-1NaOH溶液
C.2 mol·L-1MgSO4溶液D.硅酸溶胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇在生活中用途较多,下列关于乙醇的说法正确的是
A. 能与Na反应
B. 是食醋的主要成分
C. 能使红色石蕊试纸变蓝
D. 能与饱和Na2CO3溶液反应产生H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在酸性条件下有以下反应关系:KBrO3能将KI氧化成I2; Br2能将I﹣氧化为I2 . IO3﹣也能将Br﹣氧化为Br2 , 其本身被还原为I2 . 现向含有1mol KI的硫酸溶液中加入含amol KBrO3溶液,a的取值不同,所得产物也不同.下列判断正确是( )
编号 | a的取值范围 | 产物的化学式(或离子符号) |
① | a≤ | I2Br﹣ |
② |
| I2Br﹣Br2 |
③ |
| I2 IO3﹣ Br2 |
④ | a≥ | IO3﹣ Br2 |
A.①③④
B.②③④
C.①②③④
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D是中学化学的常见物质,且A,B,C均含有同一种元素.在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去).请回答下列问题: ![]()
(1)若A是一种可用于自来水消毒的黄绿色气体,D是生活中常用的金属单质,则C的化学式为;写出A与C反应的离子方程式 .
(2)若A是一种常见的强碱,C常用于糕点发酵,则反应①的离子方程式是 .
(3)若A是一种碱性气体,常用作制冷剂,B,D是空气中的主要成分,则C的化学式为 .
(4)若A是一种无色、有臭鸡蛋气味的气体,C是导致酸雨的主要气体,则反应③的方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com