
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH、Cl-、Mg2+、Ba2+、CO![]() 、SO
、SO![]() ,现取三份各100 mL溶液分别进行如下实验:
,现取三份各100 mL溶液分别进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g.根据上述实验,以下推测正确的是
A. K+一定存在 B. 100 mL溶液中含0.01 mol CO![]()
C. Cl-一定存在 D. Ba2+一定不存在,Mg2+可能存在
【答案】A
【解析】A、根据题意,Ba2+和SO42-可发生离子反应生成BaSO4沉淀,因此两者不能大量共存,Ba2+和CO32-可发生离子反应生成BaCO3沉淀,因此两者也不能大量共存。第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+=AgCl↓、CO32-+2Ag+=Ag2CO3↓、SO42-+2Ag+=Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-;第二份加足量NaOH溶液加热后,收集到气体0.04mol,能和NaOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+(Mg2+可以和OH-反应生产氢氧化镁沉淀),故可确定一定含有NH4+,一定不存在Mg2+,根据反应NH4++OH-![]() NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol;第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g,部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,因此溶液中一定存在CO32-、SO42-,一定不存在Ba2+,由条件可知BaSO4为2.33g,物质的量为2.33g÷233g/mol=0.01mol,BaCO3为6.27g-2.33g=3.94g,物质的量为3.94g÷197g/mol=0.02mol,则CO32-物质的量为0.02mol,由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+。而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,A正确;B、由上述分析可得CO32-物质的量为0.02mol,B错误;C、根据溶液中电荷守恒可知K+一定存在,C错误;D、溶液中一定不存在Mg2+、Ba2+,D错误;答案选A。
NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol;第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g,部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,因此溶液中一定存在CO32-、SO42-,一定不存在Ba2+,由条件可知BaSO4为2.33g,物质的量为2.33g÷233g/mol=0.01mol,BaCO3为6.27g-2.33g=3.94g,物质的量为3.94g÷197g/mol=0.02mol,则CO32-物质的量为0.02mol,由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+。而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,A正确;B、由上述分析可得CO32-物质的量为0.02mol,B错误;C、根据溶液中电荷守恒可知K+一定存在,C错误;D、溶液中一定不存在Mg2+、Ba2+,D错误;答案选A。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 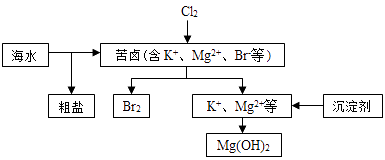
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:已知:①SO2(g)+Cl2(g)SO2Cl2(l)+Q(Q>0)
②硫酰氯常温下为无色液体,熔点为﹣54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气.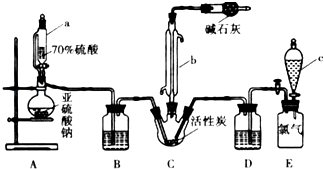
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是 .
(2)装置C中干燥管里碱石灰作用是 . 装置E为储气装置,用于提供氯气,当装置E中排出氯气1.12L(已折算成标准状况)时,最终得到5.4g纯净的硫酰氯,则硫酰氯的产率为 . 为提高硫酰氯的产率,本实验操作中还需要注意的事项有
(3)反应结束后,将C装置中三颈烧瓶里的混合物分开的实验操作是 , 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式
(4)若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.9g金属锡(Sn)跟100mL 12molL﹣1 HNO3共热一段时间.完全反应后测定溶液中c(H+)为8molL﹣1 , 溶液体积仍为100mL.产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol.由此推断氧化产物可能是( )
A.SnO24H2O
B.Sn(NO3)4
C.Sn(NO3)2
D.Sn(NO3)2和Sn(NO3)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是( )
A.分别中和pH相同的等体积的盐酸和醋酸溶液,消耗等量的NaOH
B.pH=a的CH3COOH溶液加水稀释10n倍后,pH=a+n
C.pH相等的CH3COONa、NaOH溶液中,水的电离程度相同
D.Na2CO3溶液中:c(OH﹣)=c(H+)+c(HCO ![]() )+2c(H2CO3)
)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,有pH均为9体积均为10mL的NaOH溶液和CH3COONa溶液,下列说法正确的是( )
A.两种溶液中的c(Na+)相等
B.两溶液中由水电离出的c(OH﹣)之比为 ![]()
C.分别加水稀释到100mL时,两种溶液的pH依然相等
D.分别与同浓度的盐酸反应,恰好反应时消耗的盐酸体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有KI溶液的试管中,滴入适量氯水充分反应后,再加四氯化碳振荡,静置后观察到的现象是( )
A.上层紫红色,下层接近无色
B.均匀、透明,紫红色
C.均匀、透明,无色
D.上层接近无色,下层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应N2O4(g)2NO2(g)△H=+57kJmol﹣1 , 在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( ) 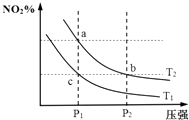
A.反应温度:T1>T2
B.a、b两点的平衡常数:Kb>Ka
C.a、c两点气体的颜色:a浅,c深
D.b、c两点的反应速率:v(b)>v(c)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com