
【题目】元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的晶胞结构如图所示。下列说法错误的是( )
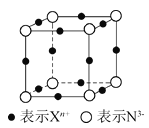
A.X元素的原子序数是19
B.该晶体中阳离子与阴离子个数比为3∶1
C.Xn+中n=1
D.晶体中每个Xn+周围有2个等距离且最近的N3-
【答案】A
【解析】
该晶胞中Xn+个数=12×![]() =3、N3-个数=8×
=3、N3-个数=8×![]() =1,所以N3-、Xn+个数之比为1∶3,根据化合价的代数和为0知n=+1,元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,则X原子核外电子数=2+8+18+1=29,为Cu元素,该化合物为Cu3N,据此分析解答。
=1,所以N3-、Xn+个数之比为1∶3,根据化合价的代数和为0知n=+1,元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,则X原子核外电子数=2+8+18+1=29,为Cu元素,该化合物为Cu3N,据此分析解答。
A.根据上述分析,X为Cu元素,核电荷数为29,故A错误;
B.该晶胞中Xn+个数=12×![]() =3、N3-个数=8×
=3、N3-个数=8×![]() =1,所以该晶体中阳离子与阴离子个数比为3∶1,故B正确;
=1,所以该晶体中阳离子与阴离子个数比为3∶1,故B正确;
C.N3-、Xn+个数之比为1∶3,根据化合物中化合价的代数和为0判断n=1,故C正确;
D.以一个棱上的Xn+为中心,该离子被4个晶胞共用,与晶体中每个Xn+周围等距离且最近的N3-只有其相邻顶点上的离子,有2个,故D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.同温同压下,1 mol N2与1 mol CO可能具有不同的体积
B.同温同压下,二氧化碳与笑气(化学式为N2O)的密度相同
C.质量相同的O2与O3,一定具有相同的原子数
D.28 g CO与1 mol CO一定具有相同的碳原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高”或“低”),其判断理由是_________________________。
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
(3)比较离子半径:F__________O2(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F和O2共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上的海水中蕴藏了大约40万亿吨氘。从1升海水里提取的氘,在聚变反应中所释放的能量,相当于燃烧300升汽油。如果把自然界的氘和氚全部用于聚变反应,释放出来的能量足够人类使用100亿年。与核裂变相比,氘和氚的聚变能是一种安全、不产生放射性物质、原料成本低廉的能源。同温同压下有等质量的H2、D2、T2三种气体,下列叙述正确的是
①密度之比为1∶2∶3 ②质子数之比为6∶3∶2 ③中子数之比为0∶6∶8 ④体积之比为6∶3∶2
A.①②③④B.只有①②C.只有③④D.只有②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于外围电子层排布为3s23p4的粒子的描述,正确的是( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物
D.其轨道表示式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+ CH3OH(l)
CH3COOC6H13(l)+ CH3OH(l)
已知v正=k正·x(CH3COOCH3)·x(C6H13OH),v逆=k逆·x(CH3COOC6H13)·x(C6H13OH),其中v正,v逆为正、逆反应速率,k正,k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(a)随时间(t)的变化关系如图所示。

该醇解反应的ΔH__0(填![]() 或
或![]() )。348K时,以物质的量分数表示的化学平衡常数Kx=__(保留2位有效数字)。
)。348K时,以物质的量分数表示的化学平衡常数Kx=__(保留2位有效数字)。
在曲线①、②、③中,k正-k逆经值最大的曲线是__;A、B、C、D四点中,v正最大的是__,v逆最大的是__。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料.则达到平衡后,初始投料比__时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx__(填增大、小不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是__。
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同的倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,回答下列问题:
(1)用分析天平准确称取该样品5.0g,全部溶于水配制成1000.0mL的溶液。用____(填一仪器名称)量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。该中和滴定中可选用的指示剂是__________________________,(如有几种,可任填一种)滴定终点的现象是___________________________________________________________。
(2)用0.10mol/L的盐酸溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 20.00 | 24.01 |
2 | 20.00 | 23.99 |
3 | 20.00 | 22.10 |
计算样品中,NaOH的质量百分含量为__________________。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果______(填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果_______;
(4)下图为0.10mol/L 25 mL NaOH溶液中逐滴滴加0.10mol/L CH3COOH溶液过程中溶液pH的变化曲线,请回答:
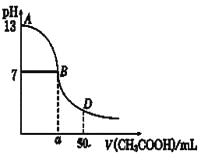
①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间。(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为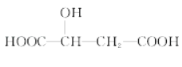 ,下列说法正确的是( )
,下列说法正确的是( )
A.1mol 苹果酸可与 3mol NaOH 发生中和反应
B.苹果酸中能发生酯化反应的官能团有 2 种
C.1mol 苹果酸与足量金属 Na 反应生成生成 1mol H2
D.HOOC—CH2—CH(OH)—COOH 与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.1molFeI2与1molCl2反应时转移的电子数为2NA
B.25℃时,pH=3的醋酸溶液1 L,溶液中含H+的数目等于0.001 NA
C.标准状况下22.4L丙烷中含C-H键数约为8NA
D.18g 2H2O 中含有的质子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com