
| A、1molO2和1molN2所占的体积都约为22.4L | ||
B、30% 氨水物质的量浓度为c,稀释至15%后,物质的量浓度比
| ||
| C、等质量的NO2和N2O4所含原子数一定相等 | ||
| D、等体积、等物质的量浓度的强酸溶液中所含的H+离子数一定相等 |
| n |
| V |
| n |
| V |
| c |
| 2 |


科目:高中化学 来源: 题型:
A、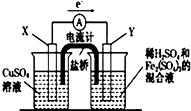 发生的反应为Cu+2Fe3+=Cu2++2Fe2+,X极是负极,Y极的材料也可以是铜 |
B、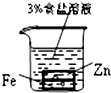 负极反应是Fe-2e-=Fe2+ |
C、 铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>都断开>只闭合K2 |
D、 可以实现在铁制品上镀上一层铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用明矾净化饮用水 |
| B、可以利用丁达尔效应鉴别胶体和溶液 |
| C、在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 |
| D、清晨的阳光穿过茂密的林木枝叶所产生的美丽的光线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只含一种元素的物质,可能为混合物 | ||
| B、非金属元素都是主族元素,最外层电子数都大于或等于3 | ||
C、
| ||
| D、工业由N2制备氨气以及由NH3氧化制备硝酸的过程都属于氮的固定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、只有② |
| C、只有③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与28 g CO具有相同分子数的CO2的质量一定是44 g |
| B、与V L CO具有相同分子数的CO2,其体积一定是V L |
| C、含有相等氧原子数的CO与CO2,其质量之比为28:11 |
| D、含有相等碳原子数的CO与CO2,其密度之比为21:22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
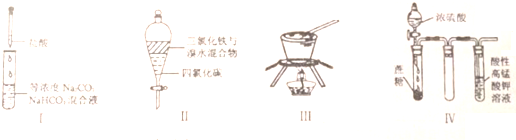 下列由相关图象作出的描述正确的是( )
下列由相关图象作出的描述正确的是( )| A、实验Ⅰ:滴加稀盐酸,NaHCO3先反应立即产生大量气泡 |
| B、实验Ⅱ:振荡后静置分层,上层无色溶液从上口倒出 |
| C、实验Ⅲ:从饱和硫酸钠溶液中提取硫酸钠晶体 |
| D、装置Ⅳ:酸性KMnO4溶液中出现气泡,溶液颜色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
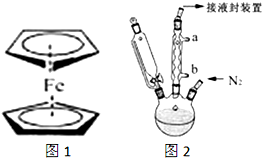 二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Br-、CO32- |
| B、Na+、I-、SO32- |
| C、Fe2+、I-、SO32- |
| D、Fe2+、Br-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com