
| ��� | ��Ӧ�� | ���� |
| �� | KMnO4��H2O2��H2SO4 | K2SO4��MnSO4���� |
| �� | Cl2��FeBr2 | FeCl3��FeBr3 |
| �� | MnO4������ | Cl2��Mn2������ |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ζ������У�������ر������������Ʊ���ԭ |
| B������ʽ�ζ�����ȡ��������Һ |
| C���÷�Ӧ�У����ĵIJ������������ص����ʵ���֮��Ϊ5:2 |
| D��Ϊ���ڵζ��յ���жϣ��ζ�ʱ��������ϵ�м���ָʾ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Tl3��>Fe3��>Ag�� | B��Fe3��>Ag��>Tl3�� |
| C��Tl��>Ag��>Fe2�� | D��Tl3��>Ag��>Fe2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����a = 0.1ʱ�������ķ�ӦΪ2Fe2++Cl2��2Fe3++2Cl�� |
| B����a = 0.45ʱ�������ķ�ӦΪ2Fe2++4Br��+3Cl2��2Fe3++2Br2+6Cl�� |
| C������Һ��Br����һ�뱻����ʱ�� c(Fe3+): c(Br��):c(Cl��) ��1:1:3 |
| D����0��a��0.15ʱ����Һ��ʼ������2c(Fe2+)+3c(Fe3+)+c(H+)��c(Cl��)+c(Br��)+ c(OH��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Tl3����Fe3����Ag�� | B��Fe3����Ag����Tl3�� |
| C��Tl����Ag����Fe2�� | D��Tl3����Ag����Fe3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A�� Ce�� Ce�� Ce�� Ce��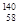 Ce�� Ce�� Ce���ǻ���Ϊͬ�������� Ce���ǻ���Ϊͬ�������� |
| B����ҵ�Ͽ��Բ��õ���Ȼ���ˮ��Һ������浥�� |
| C����������������Ҫ��ѧ����ʽ�ɱ�ʾΪ2Ce��6HI=2CeI3��3H2�� |
| D����ҵ�Ͻ�����һ�㱣���ڳ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��O2��I2��S | B��H2S��NaI��H2O |
| C��S��I2��O2 | D��H2O��NaI��H2S |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A�������������Ļ�ѧ����ʽ�ɱ�ʾΪ��Ce + 4HI  CeI4 + 2H2�� CeI4 + 2H2�� |
| B����Ce(SO4)2��Һ�ζ�����������Һ�������ӷ���ʽΪ��Ce4+ + 2Fe2+ = Ce3+ + 2Fe3+ |
| C����һ�������£��������״̬��CeO2��Ce������������� |
| D��������ֺ���13658Ce��13858Ce��14058Ce��14258Ce�����ǻ���Ϊͬ�������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com