
| A. | 容器Ⅰ、Ⅱ中正反应速率不相同 | |
| B. | 容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 | |
| C. | 容器I中反应的平衡常数小于Ⅲ中 | |
| D. | 容器Ⅲ中CO 的浓度比容器II中CO浓度的2倍还多 |
分析 A.由于该反应正向是放热反应,且三个容器均恒容绝热,因此容器Ⅰ、Ⅱ随着反应的进行温度变得不一样,平衡时各物质的浓度也不一样,正反应速率也不一样;
B.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中的基础上降低温度,平衡向正反应移动,所以容器Ⅰ中A 的物质的量比容器Ⅱ中的多;
C.K只与温度有关,Ⅰ、Ⅲ两个容器恒容绝热,反应物的量不同反应的热效应不同,体系温度不同,K不同;
D.如果是恒温的条件,容器Ⅲ中CO 的浓度比容器II中CO浓度的2倍,由Ⅲ是从正反应方向投料,所以体系温度比Ⅱ大.
解答 解:A.由于该反应正向是放热反应,且三个容器均恒容绝热,因此容器Ⅰ、Ⅱ随着反应的进行温度变得不一样,平衡时各物质的浓度也不一样,正反应速率也不一样,故A正确;
B.如果容器容器Ⅰ、Ⅱ均在恒温恒容条件下反应,那么Ⅰ、Ⅱ是等效平衡,达到平衡A的物质的量相等,而现在在恒容绝热条件下反应,正向放热,Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中的基础上降低温度,平衡向正反应移动,所以容器Ⅰ中A 的物质的量比容器Ⅱ中的多Ⅰ中A 的物质的量和容器Ⅱ中的多,故B正确;
C.K只与温度有关,Ⅰ、Ⅲ两个容器恒容绝热,反应物的量不同反应的热效应不同所以K不同,而Ⅲ放出的热量多,所以Ⅲ的温度高,而正反应是放热反应,所以平衡常数减小,则容器I中反应的平衡常数大于Ⅲ中,故C错误;
D.如果是恒温的条件,容器Ⅲ中CO 的浓度比容器II中CO浓度的2倍,由Ⅲ是从正反应方向投料,所以体系温度比Ⅱ大,Ⅲ中逆向程度大,所以容器Ⅲ中CO 的浓度比容器II中CO浓度的2倍还多,故D正确;
故选C.
点评 本题考查了化学平衡建立的过程分析,平衡影响因素分析判断,注意不要忽略容器绝热,反应的热效应,题目难度中等.


科目:高中化学 来源: 题型:解答题
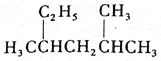 2,4-二甲基己烷
2,4-二甲基己烷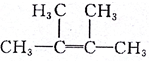 2,3-二甲基-2-丁烯
2,3-二甲基-2-丁烯查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不断补充氮气和氢气 | |
| B. | 选择20MPa-50MPa的高压 | |
| C. | 及时液化分离氨气 | |
| D. | 选择500℃左右的高温同时使用铁触媒做催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次升高 | |
| C. | N、P、F原子半径依次增大 | |
| D. | Na、K、Rb的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1molCH4分子中含有8NA个电子 | |
| B. | 常温常压下,11.2LO3中含有0.5NA个O3分子 | |
| C. | 0.1mol/LNa2SO4溶液中含Na+的数目为0.2NA | |
| D. | Na2O2与水反应产生1molO2时,转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
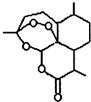 合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.
合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.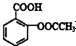 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为: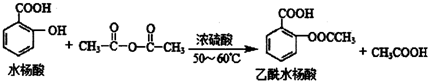
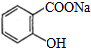 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com