
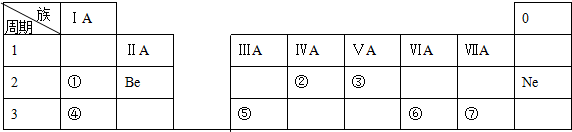

分析 由元素在周期表的位置可知,①为Li,②为C,③为N,④为Na,⑤为Al,⑥为S,⑦为Cl,据此结合各小题回答即可.
解答 解:由元素在周期表的位置可知,①为Li,②为C,③为N,④为Na,⑤为Al,⑥为S,⑦为Cl,
(1)⑦为Cl元素,故答案为:Cl;
(2)②为C元素,质子数为6,有2个电子层,最外层电子数为4,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(3)元素的金属性越强,其对应最高价氧化物的水化物的碱性越强,由于金属性Na>Al,故碱性NaOH>Al(OH)3,故答案为:>;
(4)氧化铝与硫酸反应生成硫酸铝和水,氧化物不能拆,故离子反应方程式为:Al2O3+6H+=3H2O+2Al3+,故答案为:Al2O3+6H+=3H2O+2Al3+.
点评 本题考查位置结构与性质的关系及元素周期表和元素周期律,为高频考点,把握元素的位置分析元素为解答的关键,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA | |
| B. | 假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA | |
| C. | 60g冰醋酸中,所含阴、阳离子总数为2NA | |
| D. | 标准状况下,3.36L乙烷中含有的非极性键数为1.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,结构式是F-O-O-O-F.
,结构式是F-O-O-O-F.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.
;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤⑥ | C. | ③ | D. | ②④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com