
| A. | ①② | B. | ② | C. | ③④ | D. | ④⑤ |
分析 ①A为固体,增加A的量,平衡不移动;
②增大B的浓度,平衡正向移动;
③反应前后气体的体积不变,压强增大一倍(压缩体积),正逆反应速率增大相同倍数,平衡不移动;
④升高温度,正逆反应速率均增大,平衡向吸热反应方向移动;
⑤加入催化剂,加快反应速率,平衡不移动.
解答 解:①A为固体,增加A的量,平衡不移动,故①错误;
②增大B的浓度,平衡正向移动,则改变条件瞬间v(正)>v(逆),故②正确;
③反应前后气体的体积不变,压强增大一倍(压缩体积),正、逆反应速率增大相同倍数,平衡不移动,故③错误;
④升高温度,正、逆反应速率均增大,逆反应速率增大更多,平衡向逆反应方向移动,故④错误;
⑤加入催化剂,同等程度加快正逆反应速率,平衡不移动,故⑤错误.
故选:B.
点评 本题考查化学反应速率与化学平衡影响因素,难度不大,注意理解改变条件瞬间正、逆反应速率与平衡移动方向关系.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:解答题
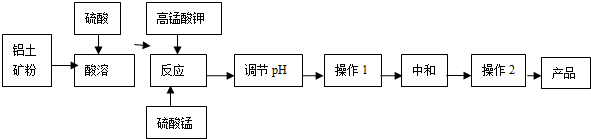
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少化石能源的使用,大力发展太阳能、风能等新能源 | |
| B. | 淘汰落后产能,将污染严重的企业从城市迁往农村 | |
| C. | 控制城市机动车持有量,实行机动车限号行驶 | |
| D. | 倡导绿色化学理念,努力实现“原子经济” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
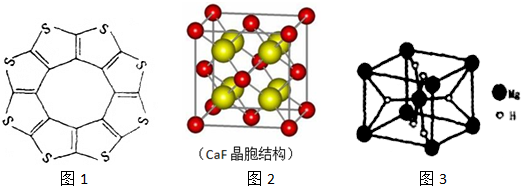
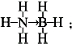 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
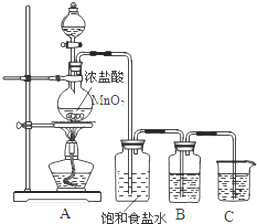 为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com