
| A. | CH3-CH3与Cl2在光照下发生取代反应 | |
| B. | CH3CH=CHCH3与Br2在四氯化碳溶液里发生加成反应 | |
| C. | CH3-CH=CH2和HCl发生加成反应 | |
| D. | 甲苯与溴混合后再加入铁粉时发生反应 |
分析 A、乙烷与氯气可以发生一氯取代、二氯取代直至六氯取代;
B、CH3CH=CHCH3与Br2发生加成反应时,从2-丁烯的结构关于双键对称,且溴中的两个溴原子完全相同来考虑;
C、CH3-CH=CH2的结构关于碳碳双键并不对称,且HCl由两个不同原子构成;
D、甲苯与液溴在溴化铁做催化剂时发生取代反应,发生取代的位置有邻位和对两个位置.
解答 解:A、乙烷与氯气的取代反应进行不彻底,故得到的是一氯乙烷、二氯乙烷、三氯乙烷、四氯乙烷、五氯乙烷、六氯乙烷和HCl的混合物,故有机产物不止一种,故A错误;
B、CH3CH=CHCH3与Br2发生加成反应时,由于2-丁烯的结构关于双键对称,且溴中的两个溴原子完全相同,故产物只有2,3-二溴丁烷一种,故B正确;
C、由于CH3-CH=CH2的结构关于碳碳双键并不对称,且HCl由两个不同原子构成,故发生加成时,可以得到1-氯丙烷和2-氯丙烷两种有机物,故C错误;
D、甲苯与液溴在溴化铁做催化剂时发生取代反应,发生取代的位置有临位和对两个位置,即可能生成邻溴甲苯和对溴甲苯两种有机物,故D错误.
故选B.
点评 本题考查了有机反应产物种类的判断,应注意从有机物的结构特点来分析,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 成分 | NaOH | Na2CO3 | H2O |
| 质量分数 | 90.4% | 3.8% | 5.8% |
| A. | 11.7 g | B. | 5.85 g | C. | 2.34 g | D. | (2.34-a) g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素X与氢可形成原子个数比为1:4的化合物 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| T/℃ | 400 | 300 |
| 平衡常致K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
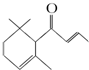 一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构如图,有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构如图,有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H18O | |
| B. | 该化合物可发生聚合反应 | |
| C. | 1 mol该化合物完全燃烧消耗18 mol O2 | |
| D. | 与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验生成的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HF>HCl>HBr>HI | |
| B. | 非金属最高氧化物的水化物酸性:HClO4>H2SO4>H2PO4>H2SiO3 | |
| C. | 金属最高价氧化物的水化物碱性:NaOH>Mg(OH)2>Al(OH)3 | |
| D. | 挥发性:HCl>HNO3>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 NaCl NaOH | B. | NaOH NaCl Na2CO3 | ||
| C. | NaCl NaOH Na2CO3 | D. | NaCl Na2CO3 NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com