
| A. | 平均反应速度:乙>甲 | B. | 平衡时nc(甲)>nc(乙) | ||
| C. | 平衡时C的转化率:甲>乙 | D. | 平衡时A的物质的量甲>乙 |
分析 甲容器为体积不变的密闭容器,而乙容器为一个恒压的密闭容器,反应C(g)?A(g)+B(g)的气体体积变大,相当于减小压强,根据压强对化学平衡的影响分析.
解答 解:甲容器为体积不变的密闭容器,而乙容器为一个恒压的密闭容器,反应C(g)?A(g)+B(g)的气体体积变大,相当于减小压强,
A.压强小,反应速率小,则平均反应速度:乙<甲,故A错误;
B.减小压强,平衡正向移动,则乙中C的含量低,即n[c(甲)]>[nc(乙)],故B正确;
C.减小压强,平衡正向移动,则乙中转化率高,即平衡时C的转化率甲<乙,故C错误;
D.减小压强,平衡正向移动,则乙中A的物质的量大,即平衡时A的物质的量甲<乙,故D错误;
故选B.
点评 本题考查化学平衡的影响因素,题目难度中等,注意固定甲不变分析是解答的关键,明确乙中压强变化即可解答,试题培养了学生的灵活应用能力.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
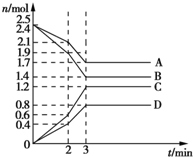 在某容积为2L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化如图所示.下列说法正确的是( )
在某容积为2L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化如图所示.下列说法正确的是( )| A. | 前2min内,v(A)=0.2 mol/(L•min) | |
| B. | 在2min时,图象发生改变的原因只可能是增大压强 | |
| C. | 其他条件不变,3min时体系的压强不再发生变化 | |
| D. | 增加气体D的浓度,A的反应速率随之减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | NaOH | C. | Mg(OH)2 | D. | NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧某白色粉末,火焰呈黄色,证明原粉末中含有Na+,无K+ | |
| B. | 实验中要配制500mL0.2mol•L-1KCl溶液,需用托盘天平称量7.45gKCl固体 | |
| C. | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结,证明NH4Cl固体易升华 | |
| D. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加沸石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱电解质的电离达到平衡状态后,电离就停止了 | |
| B. | 弱电解质的电离达到平衡状态后,分子的消耗速率和离子的生成速率相等 | |
| C. | 弱电解质的电离达到平衡状态后,分子和离子的浓度相等 | |
| D. | 弱电解质的电离达到平衡状态后,外界条件改变,电离平衡可能要发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2H+=Ca2++CO2↑+H2O | B. | 2Fe2++Cl2=2Fe3++2Cl- | ||
| C. | HCO3-+H+=CO2↑+H2O | D. | H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电解池中,物质在阴极发生氧化反应 | |
| B. | 在电解池中,与电源正极相连的电极是阴极 | |
| C. | 在原电池中,物质在负极发生氧化反应 | |
| D. | 在原电池中,电子由正极流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Cl-的溶液中肯定不存在Ag+ | |
| B. | AgI悬浊液中加入少量KI粉末,平衡AgI(s)?Ag+(aq)+I-(aq)向左移动,溶液中离子的总浓度会减小 | |
| C. | AgCl悬浊液中逐渐加入KI固体至c(I-)=$\frac{{K}_{sp}(AgI)}{{K}_{sp}(AgCl)}$mol•L-1时,AgCl开始向AgI沉淀转化 | |
| D. | 向浓度均为0.01 mol•L-1的KCl和KI的混合溶液中滴加AgNO3溶液,当Cl-开始沉淀时,溶液中I-的浓度为1.25×10-8 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com