C
分析:A、铁在氯气中燃烧生成氯化铁,根据方程式进行过量计算,由不足量的物质计算转移的电子数目;
B、过氧化钠与水反应中过氧化钠既是氧化剂也是还原剂,物质的量之比为1:1;
C、过氧化钠有钠离子和过氧根离子构成,根据m=

计算过氧化钠的物质的量,再根据N=nN
A计算过氧根离子数目;
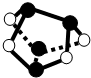
D、由结构可知,黑色球为As原子,白色球为S原子,As
4S
4分子中不含S-S键.
解答:A、5.6g铁粉在0.1mol氯气中充分燃烧生成氯化铁,5.6g铁粉反应需要0.15mol氯气,所以氯气不足,根据氯气计算转移的电子数,所以反应转移电子数为0.1mol×2×N
Amol
-1=0.2N
A,故A错误;
B、过氧化钠中被氧化的O原子与被还原的O氧原子物质的量之比为1:1,所以1molNa
2O
2与足量H
2O充分反应,转移的电子数为1mol×1×N
Amol
-1=N
A,故B错误;
C、过氧化钠有钠离子和过氧根离子构成,7.8gNa
2O
2中含有的阴离子数为
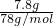
×N
Amol
-1=N
A,故C正确;
D、As原子原子半径比S原子大,由结构可知,黑色球为As原子,白色球为S原子,As
4S
4分子中不含S-S键,故D错误.
故选C.
点评:本题考查常用化学计量数的有关计算,难度不大,注意铁与氯气反应无论铁是否过量,都生成氯化铁.

 计算过氧化钠的物质的量,再根据N=nNA计算过氧根离子数目;
计算过氧化钠的物质的量,再根据N=nNA计算过氧根离子数目;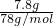 ×NAmol-1=NA,故C正确;
×NAmol-1=NA,故C正确;

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案