
| A. | 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0、△S>0 | |
| B. | 水解反应NH4++H2O?NH3•H2O+H+达到平衡后,升高温度平衡逆向移动 | |
| C. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 | |
| D. | 对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
分析 A.Mg在氯气中燃烧是放热反应,所以氯化镁分解生成Mg和氯气是吸热反应,则△H>0,反应前后气体的物质的量增加,则该反应为熵增;
B.水解反应是吸热反应,升高温度促进水解;
C.氯化铝水解生成氢氧化铝和稀盐酸,升高温度促进盐酸挥发,从而促进氯化铝水解,蒸干溶液得到氢氧化铝,灼烧氢氧化铝,氢氧化铝分解;
D.加入催化剂和升高温度都增大活化分子百分数,导致反应速率增大.
解答 解:A.Mg在氯气中燃烧是放热反应,所以氯化镁分解生成Mg和氯气是吸热反应,则△H>0,反应前后气体的物质的量增加,则该反应为熵增,所以一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0、△S>0,故A正确;
B.水解反应是吸热反应,升高温度促进水解,铵根离子水解是吸热反应,升高温度促进铵根离子水解平衡正向移动,故B错误;
C.氯化铝水解生成氢氧化铝和稀盐酸,升高温度促进盐酸挥发,从而促进氯化铝水解,蒸干溶液得到氢氧化铝,灼烧氢氧化铝,氢氧化铝分解生成氧化铝和水,所以最终得到的固体是氧化铝,故C错误;
D.加入催化剂和升高温度都增大活化分子百分数,导致反应速率增大,则对于反应2H2O2=2H2O+O2↑,二氧化锰可以作该反应的催化剂,所以加入MnO2或升高温度都能加快O2的生成速率,故D正确;
故选AD.
点评 本题考查较综合,涉及盐类水解、化学反应速率影响因素、焓变和熵变等知识点,侧重考查学生分析判断及知识灵活运用能力,明确盐类水解影响因素、化学反应速率影响因素是解本题关键,注意:蒸干氯化铝溶液得到的固体是氢氧化铝而蒸干硫酸铝溶液得到的固体是硫酸铝,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 第一次加入 | Al | Na | Zn | Mg |
| 第二次加入 | K | Mg | Al | Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H2>△H3>△H1 | B. | △H3>△H2>△H1 | C. | △H3>△H1>△H2 | D. | △H1>△H2>△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
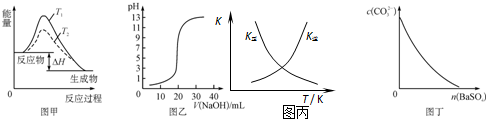
| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
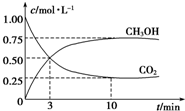 为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答下列问题:
为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只具有氧化性 | B. | 只具有还原性 | ||
| C. | 既有氧化性也有还原性 | D. | 既无氧化性也无还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com