
| △c |
| △t |
| ||
| 3min |
| ||
| 3min |
| 1 |
| 2 |


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
| A、①②③ | B、②③ |
| C、④⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、I -、NO3-、Cl - |
| B、Cu2+、Na+、NO3-、SO42- |
| C、Ag+、Fe3+、Cl-、SO42- |
| D、NH4+、OH-、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、未加入稀盐酸之前c( CN-)>c(HCN) | ||
B、加稀盐酸后溶液中
| ||
| C、pH=7时,溶液中c( Na+)=c( CN-) | ||
| D、加稀盐酸后HCN的电离程度减小,但c( H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v正(X)=v逆(Z) |
| B、容器内X、Y、Z的浓度之比为1:2:2 |
| C、容器内压强不随时间变化 |
| D、单位时间消耗0.1molX同时生成0.2molZ |
查看答案和解析>>
科目:高中化学 来源: 题型:
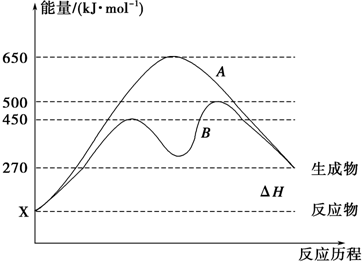
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com