
| A. | 13C与15N具有相同的中子数 | B. | 13C与C60是同一种物质 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
分析 A.根据中子数=质量数-质子数进行计算;
B.13C是一种原子,C60是由碳原子形成的分子;
C.具有相同的质子数,不同的中子数的原子,互为同位素;
D.根据核外电子数=质子数,中子数=质量数-质子数进行计算.
解答 解:A.13C的中子数=13-6=7,15N的中子数=15-7=8,故A错误;
B.13C是一种原子,C60是由碳原子形成的分子,故B错误;
C.15N与14N的质子数相同,中子数不同,故互为同位素,故C正确;
D.15N的核外电子数=质子数=7,中子数=15-7=8,故D错误;
故选C.
点评 本题考查同位素的概念及粒子间的数量关系,难度不大.要注意对于原子而言:核外电子数=质子数,中子数=质量数-质子数.


科目:高中化学 来源: 题型:解答题
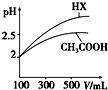 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BOH的电离方程式是BOH═B++OH- | |
| B. | 将一定体积的上述两种溶液混合后得到中性溶液,则V(HA)<V(BOH) | |
| C. | 在0.1 mol•L-1BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+) | |
| D. | 若将0.1 mol•L-1BOH溶液稀释至0.001 mol•L-1,则溶液的pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
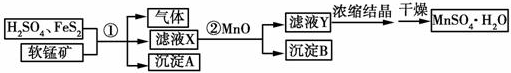
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E是有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.E是有“生物金属”之称,E4+和氩原子的核外电子排布相同. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③⑤ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
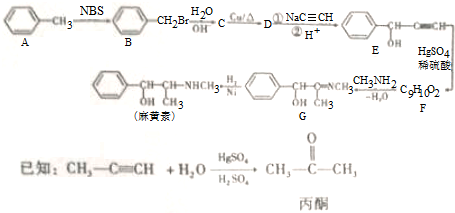

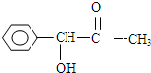 ,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种)
,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种) 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com