
����Ŀ����ͼ�dz���Ԫ�ص�����ת����ϵͼ(�������ʱ�ʡ��)��A.D�dz����������ʣ�C����Ҫ���ͻ���ϣ�G��ˮ��Һ�еμ�KSCN�ʺ�ɫ��F Ϊ����Ԫ����ɵĴ̼������壬�dz����Ĵ�����Ⱦ�������Ԫ�ص�������Ϊ1��1.����Fͨ��E��Һ�в�����ɫ����H��M�Ǻ��ɫ���塣

��1��д���������ʵĻ�ѧʽ��A____________��E___________��F___________��G___________;
��2��д�����з�Ӧ�ķ�Ӧ����ʽ����д���ӷ���ʽ�ı���д���ӷ���ʽ��
��Ӧ��____________________________________��
��Ӧ��____________________________________��
��Ӧ��____________________________________��
��3��K��M�����ַ�ʽ����ʵ��
�ټ����������Ʋ������ڿ����У���ʱ�ɹ۲쵽��������_________________________________��
��ֻ����һ�ֹ�������Lֱ��ʵ�֣���L�Ļ�ѧʽΪ��__________������n(K)��n(L)=1:1���룬���ӷ���ʽΪ____________________________________��
���𰸡� Al NaAlO2 SO2 Fe2(SO4)3 2Al+Fe2O3![]() 2Fe+Al2O3 Al2O3+2OH-=2AlO2-+H2O 2Fe3++SO2+2H2O=2Fe2++4H++SO42- �����ɰ�ɫ������Ѹ�ٱ�Ϊ����ɫ������Ϊ���ɫ Na2O2 �������10��4Na2O2+4Fe3++6H2O=4Fe(OH)3��+8Na++O2��
2Fe+Al2O3 Al2O3+2OH-=2AlO2-+H2O 2Fe3++SO2+2H2O=2Fe2++4H++SO42- �����ɰ�ɫ������Ѹ�ٱ�Ϊ����ɫ������Ϊ���ɫ Na2O2 �������10��4Na2O2+4Fe3++6H2O=4Fe(OH)3��+8Na++O2��
��������A��D�dz����������ʣ�C����Ҫ���ͻ���ϣ�G��ˮ��Һ�еμ�KSCN�ʺ�ɫ��˵��G�к�����������FΪ����Ԫ����ɵĴ̼������壬�dz����Ĵ�����Ⱦ�������Ԫ�ص�������Ϊ1��1��F��SO2��D�ڼ��ȵ���������Ũ���ᷴӦ����G��F������D��������Ӧ�������ȷ�Ӧ��A��Al��C����������M�Ǻ��ɫ���壬�ȷֽ�����B������F������������B������������Ӧ�������������������������������������������J�����ᣬK����������������Fͨ��E��Һ�в�����ɫ����H��E��ƫ�����ƣ�H������������I���������ƣ�����������ϡ���ᷴӦ���ɶ�������
��1���������Ϸ�����֪A��E��F��G�Ļ�ѧʽ�ֱ���Al��NaAlO2��SO2��Fe2(SO4)3����2����Ӧ�������ȷ�Ӧ����ѧ����ʽΪ2Al+Fe2O3![]() 2Fe+Al2O3����Ӧ�ڵ����ӷ���ʽΪAl2O3+2OH-��2AlO2-+H2O����Ӧ�ݵ����ӷ���ʽΪ2Fe3++SO2+2H2O��2Fe2++4H++SO42-����3�������������������ױ����������Լ����������Ʋ������ڿ����У��ɹ۲쵽�������������ɰ�ɫ������Ѹ�ٱ�Ϊ����ɫ������Ϊ���ɫ����ֻ����һ�ֹ�������Lֱ��ʵ�֣�˵��L����ǿ�����ԣ�ͬʱ���ܲ�������������L�ǹ������ƣ���ѧʽΪNa2O2������n(K)��n(L)=1:1���룬��Ӧ�����ӷ���ʽΪ4Na2O2+4Fe3++6H2O��4Fe(OH)3��+8Na++O2����
2Fe+Al2O3����Ӧ�ڵ����ӷ���ʽΪAl2O3+2OH-��2AlO2-+H2O����Ӧ�ݵ����ӷ���ʽΪ2Fe3++SO2+2H2O��2Fe2++4H++SO42-����3�������������������ױ����������Լ����������Ʋ������ڿ����У��ɹ۲쵽�������������ɰ�ɫ������Ѹ�ٱ�Ϊ����ɫ������Ϊ���ɫ����ֻ����һ�ֹ�������Lֱ��ʵ�֣�˵��L����ǿ�����ԣ�ͬʱ���ܲ�������������L�ǹ������ƣ���ѧʽΪNa2O2������n(K)��n(L)=1:1���룬��Ӧ�����ӷ���ʽΪ4Na2O2+4Fe3++6H2O��4Fe(OH)3��+8Na++O2����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ʵ�ת����ϵ����ͼ��ʾ������A��һ�ָ��۵���壬D��һ�ֺ���ɫ���塣

�ش��������⣺
��1��A�Ļ�ѧʽΪ___________��J�Ļ�ѧʽΪ________��G�Ļ�ѧʽΪ________��C�Ļ�ѧʽΪ___________��D�Ļ�ѧʽΪ_________
��2��д����A����H�����ӷ�Ӧ����ʽ��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���ܹ�����ˮ�ʣ������ǵ�������������ܴ���洦��
��1�� ����[KAl(SO4)2��12H2O]�dz����ľ�ˮ��������ˮ�еĵ��뷽��ʽΪ_______�������ɾ�ˮ����Ϊ����Ȼˮ�����ɽ�״Al(OH)3��Al(OH)3����____�����á�
��2����ʽ�Ȼ���(���BAC)�Ǹ�Ч��ˮ������Ҫ�ɷ֡�ʵ����ģ������������(��Ҫ��Al2O3����������Fe2O3��������������)��ȡ��ʽ�Ȼ���[Al2(OH)nCl6-n]�Ĺ�������:

�������ܽ�����������У�������Ӧ�����ӷ���ʽΪ_____________��_______���ܽ�������費�Ͻ��裬Ŀ����________________��
�����������۵���Ҫ������_______________��
������Ũ�����貣������Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������ɫ��Һ��һ���ܴ����������������
A. K+��Cu 2+��NO3-��SO42- B. K+��H+��I-��MnO4-
C. Mg2+��Na+��SO42-��OH- D. Na+��NH4+��Cl-��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£�ͬ��������嵥��X2�����嵥��Y2��������Z����������䣬��Z�Ļ�ѧʽΪ
A.X2Y2B.XYC.XY2D.X2Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������٤������ԼΪ6.02��1023 mol��1 �� ����˵����ȷ���ǣ� ��
A.2.3 g����������������Ӧ��ת�Ƶ�����Ϊ0.3��6.02��1023
B.��״���£�22.4 L�Ҵ��Ĺ��ۼ���Ϊ8��6.02��1023
C.��״���£�5.6 L��ȩ�����ĵ�����Ϊ4��6.02��1023
D.100 mL 1 molL��1������Һ�У�H+�ĸ���Ϊ0.1��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�塣
��1��������Һ��Fe3+���ڵ��Լ���________��֤��Fe3+���ڵ�������________��
��2��д��FeCl3��Һ�����ͭ������Ӧ�����ӷ���ʽ��________��
��3��ij����ʦΪ�˴�ʹ�ù��ĸ�ʴ��Һ�л���ͭ�������»�ô�����FeCl3��Һ�����������в��裺

��д������ʵ���м�������ɵ��й����ʵĻ�ѧʽ��
��________����________��
��4��Ҫ֤��ij��Һ�в���Fe3+�����ܺ���Fe2+����������ʵ�����ʱ�����˳��Ϊ________��
�ټ���������ˮ�ڼ�������KMnO4��Һ�ۼ�������KSCN��Һ
A���٢� B���ۢ� C���ۢ� D���٢ڢ�
��5��д����ڢݵĻ��Һ��ͨ������ӷ���ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ķ�Ӧ·��������Ϣ��գ� 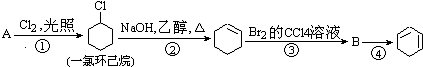
��1��A�Ľṹ��ʽ�� �� ������ ��
��2���ٵķ�Ӧ������ �� �ڵķ�Ӧ������ ��
��3����Ӧ�ܵĻ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѻ�����狀�����淋Ļ��Һa L�ֳ����ȷݣ�һ�ݼ��뺬b mol NaOH����Һ�����ȣ�ǡ�ð�NH3ȫ���ϳ�����һ��������c mol BaCl2����ʹSO42����ȫ��������ԭ��Һ��NO3�������ʵ���Ũ��Ϊ��������
A.![]()
B.![]()
C.![]()
D.![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com