
分析 (1)硫酸的第一步电离是完全的:H2SO4=H++HSO4-,第二步电离并不完全:HSO4-?H++SO42-.Na2SO4溶液存在SO42-+H2O?OH-+HSO4-,溶液呈弱碱性;
(2)A.溶液中没有H2SO4分子;
B.根据质子守恒分析;
C.根据溶液中的电荷守恒分析;
D.根据Na原子与S原子之间的关系分析;
(3)依据硫酸在水中的第一步电离是完全的,第二步电离并不完全,结合平衡移动分析判断;
(4)0.1mol•L-1的NaHSO4溶液中c(SO42-)=0.029mol•L-1,则c(HSO4-)>c(SO42-),溶液显酸性;
(5)依据氢离子浓度对硫酸氢根离子的电离平衡影响分析判断.
解答 解:(1)根据硫酸的第一步电离是完全的:H2SO4=H++HSO4-,第二步电离并不完全:HSO4-?H++SO42-,则Na2SO4溶液存在SO42-+H2O?OH-+HSO4-,溶液呈弱碱性,
故答案为:碱性;SO42-+H2O?OH-+HSO4-;
(2)A.溶液中没有H2SO4分子,c(SO42-)+c(HSO4-)=0.1mol•L-1,故A错误;
B.溶液中存在质子守恒,即c(OH-)=c(H+)+c(HSO4-),故B正确;
C.溶液中存在电荷守恒,即阴离子的负电荷总数等于正电荷总数,则c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-),故C正确;
D.c(Na)=2c(S),根据S在溶液中存在形式可知:c(Na+)=2c(SO42-)+2c(HSO4-),故D正确;
故答案为:BCD;
(3)25℃时,0.10mol•L-1的NaHSO4溶液中c( SO42-)=0.029mol•L-1,则0.10mol•L-1的H2SO4溶液中氢离子浓度比硫酸氢钠溶液中大,对硫酸氢根离子电离平衡起到抑制作用,c( SO42-)<0.029mol•L-1;
故答案为:<;H2SO4溶液中氢离子浓度比硫酸氢钠溶液中大,对硫酸氢根离子电离平衡起到抑制作用;
(4)0.1mol•L-1的NaHSO4溶液中c(SO42-)=0.029mol•L-1,则c(HSO4-)>c(SO42-),溶液显酸性,所以溶液中离子浓度大小关系为:c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-);
故答案为:c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-);
(5)若25℃时,0.10mol•L-1H2SO4溶液的pH=-lgO.11,C(H+)=0.11mol/L;依据:①H2SO4=H++HSO4-,②HSO4-?H++S042-.①电离出的氢离子浓度为0.10mol/L;所以②电离出的氢离子浓度为0.11mol/L-0.1.mol/L=0.01mol/L;则0.10mol•L-1的H2SO4溶液中c(SO42-)=0.01mol/L;
故答案为:0.01mol/L.
点评 本题考查电解质的电离和离子方程式的书写,溶液中电荷守恒应用,物料守恒的应用,题目难度中等,本题注意把握题意,突破硫酸为二元强酸的思维,从题目实际出发,加强自学能力的培养.


科目:高中化学 来源: 题型:选择题
| A. | B的平均消耗速率为0.3mol(L•min) | |
| B. | C的平衡浓度为2mol/L | |
| C. | 平衡后,增大压强,平衡将向正方向移动 | |
| D. | 若单位时间内生成的B和C的物质的量之比为3:2,则体系处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
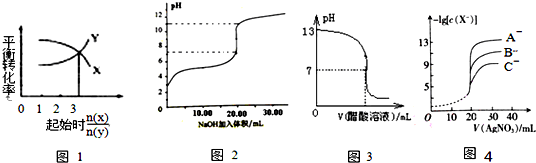
| A. | 一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3Y?Z | |
| B. | 图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 | |
| C. | 常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示.当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是A- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠块沉在乙醇液面下面 | B. | 钠块熔成小球 | ||
| C. | 钠块在乙醇液面上游动 | D. | 钠块表面无气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6 kJ/mol
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6 kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3═2Na++CO32- | B. | H2O═2H++O2- | ||
| C. | HNO3═H++NO3- | D. | K2SO4═2K++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com