
【题目】电解质溶液相关问题
(1)下列事实可证明氨水是弱碱的是_______(填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0.1 mol·L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0.1 mol· L-1氯化铵溶液的pH 为5
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于7,则溶液中c(H2CO3)_______c(CO32-)(填“>”、 “=”或“<”),原因是________(文字说明);常温下,已知0.1 mol·L-1NaHCO3溶液的pH等于8,则溶液中c(H2CO3)-c(CO32-)=_____________mol··L-1(写出计算数值结果)。
(3)现有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是_____________。
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1 mol·· L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
(4)用标准浓度的酸性KMnO4溶液滴定草酸(H2C2O4)溶液的测定其物质的量浓度。
① 滴定时,KMnO4溶液应装在__________(填“酸式”、“碱式”)滴定管中。
②滴定达到终点的标准是:__________________。
③滴定时所发生反应的离子方程式:_____________________。
④实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是___________。
A.称取草酸晶体(7.2g)时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失
【答案】 BD > HCO3-的水解程度大于HCO3-的电离程度 9.9×10-7 C 酸式 最后一滴,KMnO4溶液加入时,溶液由无色变为浅紫红色且半分钟内不变色 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O(没配平不给分) BD
【解析】(1)考查弱电解质的判断,A、反应生成Fe(OH)3,只能说明氨水显碱性,无法判断是弱碱,故A错误;B、假设NH3·H2O是强碱,此时的pH=13>11,说明NH3·H2O是弱碱,故B正确;C、铵盐受热易分解,说明铵盐不稳定,不能说明NH3·H2O是弱碱,故C错误;D、NH4Cl属于盐,其水溶液的pH=5,说明溶液显酸性,即NH4+水解,NH3·H2O属于弱碱,故D正确;(2)考查离子浓度大小的比较,NaHCO3溶液显碱性,说明HCO3-的水解程度大于其电离程度,HCO3-的水解HCO3-+H2O ![]() H2CO3+OH-,HCO3-的电离,HCO3-
H2CO3+OH-,HCO3-的电离,HCO3-![]() H++CO32-,水解程度微弱,因此有c(HCO3-)>c(CO32-);根据物料守恒,有c(HCO3-)+c(CO32-)+c(H2CO3)=c(Na+)=0.1mol·L-1,电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),两式联立解得,c(H2CO3)-c(CO32-)=c(OH-)-c(H+)=10-6-10-8=9.9×10-7mol·L-1;(3)考查盐类水解的规律和弱电解质的电离平衡,A、浓度相同、体积相同,NaOH属于强碱,碱性最强,碳酸的酸性弱于醋酸,因此CO32-的水解程度大于CH3COO-,因此Na2CO3的碱性强于CH3COONa,因此碱性顺序是③>①>②,故A错误;B、NaOH是强碱,稀释相同倍数,NaOH的pH变化最大,故B错误;C、反应后溶液中的溶质分别是NaHCO3(NaCl)、CH3COOH(NaCl)和NaCl,溶液分别显碱性、酸性、中性,因此pH最大的是①,故C正确;D、pH相同,弱的浓度最大,即浓度顺序是②>①>③,故D错误;(4)考查滴定实验,①酸式滴定管盛放酸性溶液和氧化剂,碱式滴定管盛放碱性溶液,因此酸性高锰酸钾溶液盛放在酸式滴定管中;②用高锰酸钾溶液滴定草酸,滴定到终点的标志:最后一滴KMnO4溶液加入时,溶液由无色变为浅紫红色且半分钟内不变色 ;③利用高猛酸钾溶液的氧化性,把H2C2O4氧化成CO2,本身被还原成Mn2+,然后利用化合价的升降法进行配平,因此离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;④建立的关系:c(H2C2O4)=2c(MnO4-)×V标/5V待,A、草酸晶体放在右盘,称量7.2g草酸晶体,砝码的质量=游码+药品,药品质量的减少,因此测定结果偏低,故A错误;B、用草酸溶液润洗锥形瓶,锥形瓶中草酸的物质的量增加,消耗的高锰酸钾溶液的体积增大,即所测草酸的浓度偏高,故B正确;C、开始仰视读数,滴定结束俯视读数,高锰酸钾溶液体积减小,即所测草酸浓度偏低,故C错误;D、尖嘴部分有气泡,滴定后气泡消失,高锰酸钾溶液的体积增大,所测草酸浓度增大,故D正确。
H++CO32-,水解程度微弱,因此有c(HCO3-)>c(CO32-);根据物料守恒,有c(HCO3-)+c(CO32-)+c(H2CO3)=c(Na+)=0.1mol·L-1,电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),两式联立解得,c(H2CO3)-c(CO32-)=c(OH-)-c(H+)=10-6-10-8=9.9×10-7mol·L-1;(3)考查盐类水解的规律和弱电解质的电离平衡,A、浓度相同、体积相同,NaOH属于强碱,碱性最强,碳酸的酸性弱于醋酸,因此CO32-的水解程度大于CH3COO-,因此Na2CO3的碱性强于CH3COONa,因此碱性顺序是③>①>②,故A错误;B、NaOH是强碱,稀释相同倍数,NaOH的pH变化最大,故B错误;C、反应后溶液中的溶质分别是NaHCO3(NaCl)、CH3COOH(NaCl)和NaCl,溶液分别显碱性、酸性、中性,因此pH最大的是①,故C正确;D、pH相同,弱的浓度最大,即浓度顺序是②>①>③,故D错误;(4)考查滴定实验,①酸式滴定管盛放酸性溶液和氧化剂,碱式滴定管盛放碱性溶液,因此酸性高锰酸钾溶液盛放在酸式滴定管中;②用高锰酸钾溶液滴定草酸,滴定到终点的标志:最后一滴KMnO4溶液加入时,溶液由无色变为浅紫红色且半分钟内不变色 ;③利用高猛酸钾溶液的氧化性,把H2C2O4氧化成CO2,本身被还原成Mn2+,然后利用化合价的升降法进行配平,因此离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;④建立的关系:c(H2C2O4)=2c(MnO4-)×V标/5V待,A、草酸晶体放在右盘,称量7.2g草酸晶体,砝码的质量=游码+药品,药品质量的减少,因此测定结果偏低,故A错误;B、用草酸溶液润洗锥形瓶,锥形瓶中草酸的物质的量增加,消耗的高锰酸钾溶液的体积增大,即所测草酸的浓度偏高,故B正确;C、开始仰视读数,滴定结束俯视读数,高锰酸钾溶液体积减小,即所测草酸浓度偏低,故C错误;D、尖嘴部分有气泡,滴定后气泡消失,高锰酸钾溶液的体积增大,所测草酸浓度增大,故D正确。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是

A. XZ线上任意点均呈中性,pH=7
B. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
C. M区域内任意点均有c(H+)<c(OH-)
D. 图中T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将1mol H2和11.2 L O2混合,得到气体的体积为( )
A.12.2 L B.<22.4 L C.33.6 L D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检测某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组设计了如下实验流程:

(1)通入N2的目的是_______________________
(2)第①步反应的离子方程式是______________________
(3)滴定实验若选择酚酞作指示剂,则滴定终点的标志是________滴定过程中以下操作使测定结果偏高的是________(填编号)
a. 洗净的滴定管未用标准液润洗
b. 滴定中向锥形瓶内壁加少量水
c. 滴定前滴定管正常,滴定后尖嘴部分有气泡
d. 锥形瓶用待测液洗涤2-3次
(4)若实验室欲制取SO2可选用试剂__________(填编号)
a. 铜和浓硫酸 b. 硫和氧气
c. 亚硫酸钠和浓度70%的硫酸 d. 亚硫酸钙和硝酸
(5)往BaCl2溶液中通入SO2至饱和,无明显现象,再通入NH3后出现白色沉淀,此时溶液中一定有的溶质是_________。请用电离平衡解释上述实验现象:_________________
(6)H2O2是一种绿色氧化剂。某NH4Cl样品中含少量Fe2+、SO42-,将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,即得到工业氯化铵。
滤渣的主要成分是_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol/L的硫酸溶液的含义是( )
A.1L水中含有1molH2SO4 B.一定量的溶液中含有1molH2SO4
C.将98g浓硫酸溶于水配成1L溶液 D.指1L硫酸溶液中含有98gH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的.主要步骤如下:
下列说法不正确的是( )
A. 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳
B. 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤
C. 加入试剂②反应的离子方程式为:OH﹣+H+=H2O
D. 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某钴矿石的主要成分为Co2O3,同时含有少量Fe2O3、Al2O3、MnO、MgO、CaO等杂质。用该种钴矿石制取CoC2O4·2H2O的工艺流程如下:

①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形成沉淀时溶液的pH见下表:
![]()
(1)写出两条提高浸出速率所采取的措施_______、________。
(2)浸出过程中加入Na2SO3的主要目的是___________。
(3)沉淀1的成分是___________(写化学式)。
(4)在C1O3-和Co3+中,氧化性最强的是_____________。
(5)浸出液中加入NaC1O3所发生反应的离子方程式为_________。
(6)滤液II中加入萃取剂的作用是__________。
(7)“操作X”包括______和_____________。
(8)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。当加入过量NaF后,所得滤液中c(Mg2+):c(Ca2+)= 0.67,则Ksp(MgF2)=_________(已知Ksp(CaF2)=1.10×10-10)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如下图,依图所示:
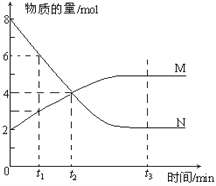
(1)该反应的化学方程式是_____________________。
(2)在图上所示的三个时刻中,_____(填t1、t2或t3)时刻处于平衡状态,此时V正____V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)﹕v(M)= _____。
(3)若反应容器的容积不变,则“压强不再改变”_______(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是_____(选填字母)。
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为
A. 1:1 B. 2:3 C. 3:2 D. 1:6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com