
| A. | HCl | B. | H2SO4 | C. | CH3COOH | D. | ( NH4)2SO4 |
分析 物质的量浓度都是0.1mol/L的这几种溶液,溶液中氢离子浓度越大其溶液酸性越强,据此分析解答.
解答 解:物质的量浓度都是0.1mol/L的这几种溶液,溶液中氢离子浓度越大其溶液酸性越强,硫酸铵是强酸弱碱盐,铵根离子水解较弱,所以溶液酸性较弱;
醋酸是弱酸,氢离子浓度小于0.1mol/L,酸性较弱但大于硫酸铵;
HCl、硫酸都是强电解质,盐酸中氢离子浓度小于硫酸,所以硫酸酸性最强、盐酸酸性次之,
通过以上分析知,酸性强弱顺序是B>A>C>D,故选B.
点评 本题考查物质的量浓度计算,为高频考点,侧重考查盐类水解、强弱电解质的电离等知识点,明确物质性质是解本题关键,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4 Na2CO3 Ca(OH)2 | B. | HCl NaOH K2CO3 | ||
| C. | H2CO3 C2H5OH NaHSO4 | D. | Ba(OH)2 H3PO4 KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度分别为2 mol/L和1 mol/L的Na2CO3溶液中,C(CO32一)的比值为2:1 | |
| B. | 常温常压下,16 g 02和O3混合气体中含有NA个氧原子 | |
| C. | 46 g NO2和N204混合气体的物质的量之和大于O.5 mol,小于l mol | |
| D. | 向饱和CuS04溶液中加入1 mol CuS04固体,则析出的晶体的质量大于250 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和 HC1溶液混合:Mg2++2OH-=Mg(OH)2↓ | |
| C. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | |
| D. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为Cl2>Br2>KBrO3>KClO3 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为5:1 | |
| D. | 反应③中1 mol KBrO3参加反应时有10 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol锌粒与足量盐酸反应产生11.2 L H2 | |
| B. | 标准状况下,18g的H2O中含有的电子数为10NA | |
| C. | 常温常压下,11.2L氧气所含的原子数为NA | |
| D. | 2.4g金属镁变为镁离子失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
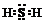 .
.| 操作 | 现象 |
| ①取B的溶液加入过量浓 NaOH溶液并加热 | 产生白色沉淀和无色刺激性气味气体; 过一段时间白色沉淀变为灰绿色,最终变为红褐色; |
| ②另取B的溶液, 加入过量BaCl2溶液 | 产生白色沉淀,加盐酸沉淀不溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L | B. | 1.5 mol/L | C. | 2mol/L | D. | 3 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com