
【题目】有机化合物J是在医疗上有重要的应用,分子结构中含有3个六元环.其中一种合成路线如图: 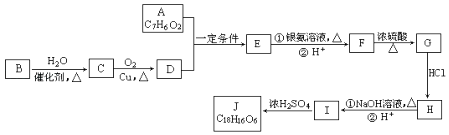
已知:
①A既能发生银镜反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱显示有4个吸收峰,且峰面积之比为1:2:2:1.
②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平.
③R1﹣CHO+R2﹣CH2﹣CHO ![]()
![]()
请回答下列问题:
(1)E的结构简式是 , G中含氧官能团的名称 .
(2)写出有机反应类型H→I , F→G .
(3)写出I生成J的化学方程式 .
(4)A的含苯环同分异构体有种,写出其中符合以下要求的同分异构体的结构简式 . ①能发生银镜反应 ②能发生水解反应 ③含有苯环
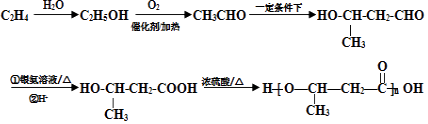
(5)写出用B合成 ![]() 的路线图(提示:路线图的书写方法RCH=CH2
的路线图(提示:路线图的书写方法RCH=CH2![]()
![]()
![]() )
)
【答案】
(1)![]() ;羟基、羧基
;羟基、羧基
(2)水解反应(或取代反应);消去反应
(3)2 ![]()
![]()
![]() +2H2O
+2H2O
(4)4;HCOO﹣C6H5
(5)
【解析】解:(1)由上述分析可知,E的结构简式是 ![]() ,G为
,G为 ![]() ,含氧官能团的名称为羟基、羧基, 所以答案是:
,含氧官能团的名称为羟基、羧基, 所以答案是: ![]() ;羟基、羧基;(2)有机反应类型H→I为卤代烃的水解反应(或取代反应),F→G为醇的消去反应,
;羟基、羧基;(2)有机反应类型H→I为卤代烃的水解反应(或取代反应),F→G为醇的消去反应,
所以答案是:水解反应(或取代反应);消去反应;(3)I生成J的化学方程式为2 ![]()
![]()
![]() +2H2O,
+2H2O,
所以答案是:2 ![]()
![]()
![]() +2H2O;4)A为
+2H2O;4)A为 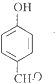 ,含苯环同分异构体有苯环与﹣COOH相连、与﹣OOCH相连、与﹣OH、﹣CHO存在邻、间位,共4种,其中符合①能发生银镜反应、②能发生水解反应、③含有苯环的同分异构体的结构简式为HCOO﹣C6H5 , 所以答案是:4;HCOO﹣C6H5;(5)合成
,含苯环同分异构体有苯环与﹣COOH相连、与﹣OOCH相连、与﹣OH、﹣CHO存在邻、间位,共4种,其中符合①能发生银镜反应、②能发生水解反应、③含有苯环的同分异构体的结构简式为HCOO﹣C6H5 , 所以答案是:4;HCOO﹣C6H5;(5)合成 ![]() ,由逆合成法可知,OHCH(CH3)CH2COOH←OHCH(CH3)CH2CHO←CH3CHO←CH3CH2OH←CH2=CH2 , 则合成流程图为
,由逆合成法可知,OHCH(CH3)CH2COOH←OHCH(CH3)CH2CHO←CH3CHO←CH3CH2OH←CH2=CH2 , 则合成流程图为 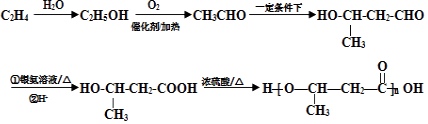 ,
,
所以答案是:  .
.


科目:高中化学 来源: 题型:
【题目】在标准状况下,等质量的CH4 和CO2比较,下列说法中正确的是
A. 密度比4:11 B. 分子数之比为4:11
C. 体积比4:11 D. 物质的量之比为4:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应。又知E溶液是无色的,F溶液是浅绿色的。

请回答:
(1)试写出下列物质的化学式:A____________________,B_____________________。
(2)反应①的化学方程式:___________,E溶液中溶质的电离方程式是____________。
(3)反应③的离子方程式:________________________________。
(4)工业上经常利用B气体制取漂白粉,该反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)

根据以上信息填空:
(1)写出下列物质的化学式:A______ G__________ ;
(2)纯净的气体甲在气体乙中燃烧的现象:______________________________________;
(3)写出下列反应的离子方程式:反应①_________________________;反应④____________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下二氯化二硫(S2 Cl2)为红棕色液体,其结构式为Cl-S-S-Cl。其制备反应及与水反应的化学方程式如下:①CS2+3Cl2![]() CCl4+S2Cl2 ②2S2Cl2+2H2O=4HCl+SO2↑+3S↓,则下列说法正确的是
CCl4+S2Cl2 ②2S2Cl2+2H2O=4HCl+SO2↑+3S↓,则下列说法正确的是
A. 反应①中CS2作氧化剂
B. 反应①中每生成1mol S2Cl2转移4mol电子
C. 反应②中氧化产物与还原产物的物质的量之比为3:1
D. 反应②中S2Cl2既作氧化剂又作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可以表示为FeOCr2O3 , 还含有SiO2、Al2O3杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)过程如图所示. 
已知:CrO42﹣和Cr2O72﹣在酸性条件下可以相互转化.
请回答下列问题:
(1)完成并配平下列方程式: 6FeO+6Cr2O3+KOH+KClO3=K2CrO4+Fe2O3+KCl+
(2)滤渣1的成分是(填化学式),滤液1的成分除K2CrO4、KClO3、KOH外,还含有(填化学式),过滤后洗涤沉淀的操作是 .
(3)试剂1是(填化学式),利用滤渣2可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,电解时阴极的电极反应式为 .
(4)对滤液2用稀硫酸酸化处理时发生的离子反应方程式是 , 酸化处理时往往增大稀硫酸浓度的原因是 .
(5)检验氯酸钾晶体中钾元素的具体方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )

A. 曲线a表示Na+的物质的量的变化
B. 曲线c表示Ba2+的物质的量的变化
C. 加入50 mL Ba(OH)2溶液时反应的离子方程式为Ba2++2OH-+2H++ ![]() BaSO4↓+2H2O
BaSO4↓+2H2O
D. 加入Ba(OH)2溶液体积大于50 mL后,反应的离子方程式为OH-+H+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学,在学习了钠的性质后,用小刀切割了一小块钠,然后放入盛有空气的集气瓶中,充分燃烧后发现瓶壁上有黑色固体附着,下面是该兴趣小组的几点推测,你认为不合理的是( )
A. 黑色固体是碳
B. 钠在燃烧时只发生了一个反应
C. 钠在金属活动性顺序中排在镁前面,所以钠能与二氧化碳反应(已知:2Mg+CO2![]() 2MgO+C)
2MgO+C)
D. 钠保存在煤油中,可能滤纸没有完全吸干煤油,煤油不完全燃烧产生碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com