
【题目】下列热化学方程式中.△H能正确表示物质的燃烧热的是( )
A.CO(g) +![]() O2(g) ==CO2(g); △H=-283.0 kJ/mol
O2(g) ==CO2(g); △H=-283.0 kJ/mol
B.C(s) +![]() O2 ==CO(g); △H=-110.5 kJ/mol
O2 ==CO(g); △H=-110.5 kJ/mol
C.H2(g) +![]() O2(g)==H2O(g); △H=-241.8 kJ/mol
O2(g)==H2O(g); △H=-241.8 kJ/mol
D.2C8H18(l) +25O2(g)==16 CO2(g)+18 H2O(l); △H=-1136 kJ/mol
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:

下列叙述错误的是
A. X、Y和Z均能使溴水褪色
B. X和Z均能与NaHCO3溶液反应放出CO2
C. Y既能发生取代反应,也能发生加成反应
D. Y可作加聚反应单体,X可作缩聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是一种强还原性的碱性液体,是一种用途广泛的化工原料,实验室用如图装置制备(部分装置省略)。

步骤1关闭K2、K3,打开K1,制备NaClO。
步骤2关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,通入NH3,制备N2H4·H2O。
回答下列问题:
(1)盛放碱石灰的仪器的名称为___________。
(2)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有__________(填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(3)步骤2中通入N2一段时间的原因是____________________。
(4)本装置中制备氨气的化学方程式是______________________________。
(5)NH3与NaClO反应生成N2H4·H2O的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:xA(g)+yB(g) ![]() pC(g)+qD(g)已知:平均反应速率v(C)=
pC(g)+qD(g)已知:平均反应速率v(C)=![]() v(A);反应2min时,A的浓度减少了
v(A);反应2min时,A的浓度减少了![]() ,B的物质的量减少了
,B的物质的量减少了![]() mol,有
mol,有![]() molD生成。回答下列问题:
molD生成。回答下列问题:
(1)反应2min内,v(A)=______________;v(B)=______________;
(2)下列叙述能说明该反应已达平衡状态的是:______;
A、 xV(A)正=qV(D)逆 B、气体总的质量保持不变 C、C的总质量保持不变 D、混合气体总的物质的量不再变化 E、混合气体总的密度不再变化 F、混合气体平均分子量不再变化
(3)反应平衡时,D为2amol,则B的转化率为________;
(4)其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较,反应速率_____(是“增大”“减小”或“不变”),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
(4)利用氧化还原滴定方法,在70~80 ℃条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1 h的目的是_____。
(2)如何保证在70~80 ℃ 条件下进行滴定操作:_____。
(3)准确量取一定体积的KMnO4溶液用_____(填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用____(填序号)。
A.H2C2O4·2H2O B.FeSO4
C.浓盐酸 D.Na2SO3
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL:
①滴定终点标志是___;
②所配制KMnO4标准溶液的物质的量浓度为__ mol·L-1;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将___(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《科学美国人》评出的2016年十大创新技术之一是碳呼吸电池,电池原理如图所示,则下列有关说法正确的是

A.以此电池为电源电解精炼铜,当有0.1 mol 电子转移时,有3.2 g铜溶解
B.正极每消耗4.48L的CO2,则生成0.1molC2O42-
C.每生成1 mol Al2(C2O4)3,有6 mol电子流过草酸盐溶液
D.随着反应进行,草酸盐浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图所示(加热、搅拌和仪器固定装置均已略去)。

实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中;
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2∶1.5)溶液;
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体;
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为________;
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是_________;
(3)装置C用于尾气吸收,当尾气中n(NO2)∶n(NO)=1∶1时,过量的NaOH溶液能将NO,全部吸收,原因是_________(用化学方程式表示);
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是________;
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答有关问题:
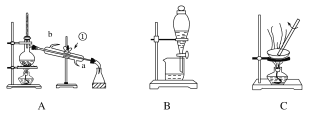
(1)装置A中玻璃仪器①的名称是________,进水的方向是从____口(填字母)进水。
(2)利用装置B分液时为使液体顺利滴下,应进行的具体操作是_________________。
(3)从氯化钾溶液中得到氯化钾固体,应选择装置________(填字母,下同);从碘水中分离出I2,应选择装置________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。

资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为2NaClO3 + 4HCl= 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O。
①冰水浴的作用是____________。
② NaOH溶液中发生的主要反应的离子方程式为________________。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到____,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO2-),需将其转化为Cl-除去。下列试剂中,可将ClO2-转化为Cl-的是_____________________(填字母序号)。
a. FeSO4 b. O3 c. KMnO4 d. SO2
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备K2FeO4的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
①上述制备K2FeO4反应的离子方程式为______________________。
②净水过程中,K2FeO4起到吸附、絮凝作用的原理是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com