
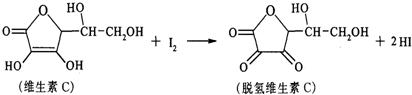
| A. | 上述反应为取代反应 | |
| B. | 维生素C能使高锰酸钾酸性溶液褪色 | |
| C. | 维生素C不溶于水,可溶于有机溶剂 | |
| D. | 维生素C的分子式为C6H10O6 |
分析 A.取代反应是指机物分子里的原子或原子团被其他原子或原子团代替的反应,根据反应物及生成物的结构、分子组成判断;
B.维生素C中含有碳碳双键,具有烯烃性质;
C.维生素C中含有多个亲水基,其易溶于水;
D.根据结构简式确定其分子式.
解答 解:A.根据反应前后物质结构特点知,该反应是氧化反应,而不是取代反应,故A错误;
B.维生素C中含有碳碳双键,具有烯烃性质,所以维生素C能使高锰酸钾酸性溶液褪色,故B正确;
C.维生素C中含有多个亲水基,其易溶于水,故C错误;
D.根据结构简式确定其分子式为C6H8O6,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,侧重考查基本概念、烯烃、醇的性质,明确官能团及其性质关系是解本题关键,易错选项是A.


科目:高中化学 来源: 题型:解答题
 醋酸是中学常用的一种弱酸.
醋酸是中学常用的一种弱酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠可用作漂白剂和呼吸面具中的供氧剂 | |
| B. | 钠和钾的合金常温下是固体,可用于快中子反应堆作热交换剂 | |
| C. | 碳酸氢钠是焙制糕点所用的发酵粉之一,也可以用于治疗胃酸过多 | |
| D. | 热的碳酸钠溶液可以去除物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CN-)<c(HCN) | B. | c(HCN)+c(CN-)═0.04 mol/L | ||
| C. | c(OH-)═c(H+)+c(HCN) | D. | c(Na+)>c(CN-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.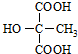 (或
(或 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4am/b | B. | 22.4b/am | C. | 22.4bm/a | D. | 22.4a/bm |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com