
【题目】某同学设计如图所示装置制备一硝基甲苯
 甲苯
甲苯
已知.30℃左右主要产物为一硝基甲苯,温度过高时会生成二硝基甲苯和三硝基甲苯。
实验步骤如下.
①配制浓硫酸和浓硝酸(按体积比1.3)的混合物(混酸)
②在三颈瓶里装15ml甲苯
③装好其它药品,并组装好仪器
④向三颈烧瓶中加入混酸,并不断搅拌
⑤控制温度,大约反应10min至三颈烧瓶底有大量液体(淡黄色油状)出现
⑥分离出一硝基甲苯。(已知.甲苯的密度为0.866g/ml,沸点为110.6℃,硝基苯的密度为1.20g/ml,沸点为210.9℃)
根据上述实验,回答下列问题
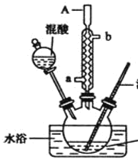
(1)实验方案中缺少一个必要的仪器,它是___________。本实验的关键是控制温度在30℃左右在,如果温度过高,产生的后果是_____________________________________。
(2)简述配制混酸的方法_______________________________________________________,浓硫酸的作用是______________________________。
(3)A仪器的名称是_________________进水口是________________。
(4)写出甲苯与混酸反应生成间硝基甲苯的化学方程式___________________________。
(5)分离产品方案如图所示

操作2的名称是_________________。
(6)经测定,产品1为一硝基甲苯,其核磁共拜氢谱中有3个峰,则其结构简式为_________________。
【答案】温度计 生成二硝基甲苯和三硝基甲苯 量取30ml浓硝酸倒入烧杯中,再量取10ml浓硫酸沿烧杯内壁缓缓注入烧杯并不断搅拌 催化剂、脱水剂 球形冷凝管 a ![]() +HNO3(浓)→
+HNO3(浓)→  + H2O 蒸馏
+ H2O 蒸馏 ![]()
【解析】
(1)水浴加热需用温度计控制温度;温度过高时会生成二硝基甲苯和三硝基甲苯;
(2)浓硫酸稀释时释放大量的热,则配制混酸时应向硝酸中加入浓硫酸,边加边搅拌;浓硫酸在制取硝基苯时作催化剂和脱水剂;
(3)A仪器的名称为球形冷凝管,冷凝水应下进上出,即a口进;
(4)甲苯与浓硝酸在浓硫酸加热的条件下生成硝基甲苯和水;
(5)根据沸点不同分离多种相互溶解的物质采用蒸馏的方法;
(6)一硝基甲苯核磁共拜氢谱中有3个峰,则苯环上的氢原子对称,可确定硝基与甲基在苯环的对位。
(1)已知30℃左右主要产物为一硝基甲苯,装置需要水浴加热,需用温度计控制温度;温度过高时会生成二硝基甲苯和三硝基甲苯,本实验的关键是控制温度在30℃左右;
(2)浓硫酸稀释时释放大量的热,则配制混酸时应向硝酸中加入浓硫酸,边加边搅拌,方法为量取30ml浓硝酸倒入烧杯中,再量取10ml浓硫酸沿烧杯内壁缓缓注入烧杯并不断搅拌;浓硫酸在制取硝基苯时作催化剂和脱水剂;
(3)A仪器的名称为球形冷凝管,冷凝水应下进上出,即a口进;
(4)甲苯与浓硝酸在浓硫酸加热的条件下生成硝基甲苯和水,方程式为![]() +HNO3(浓)→
+HNO3(浓)→ 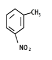 +H2O;
+H2O;
(5)根据沸点不同分离多种相互溶解的物质采用蒸馏的方法;
(6)产品1为一硝基甲苯,其核磁共拜氢谱中有3个峰,甲基上一种氢原子,则苯环上有二种,可确定硝基与甲基在苯环的对位,即![]() 。
。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各离子能在指定溶液中一定大量共存的是( )
A.使甲基橙变红的溶液:Fe2+、NO3-、SO42-、Na+
B.加入铝粉放出氢气的溶液:Na+、Cl-、NH4+、NO3-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.![]() 值为100的溶液:S2-、Na+、SO42-、SO32-
值为100的溶液:S2-、Na+、SO42-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:![]() (Q>0),达到平衡后,改变一个条件,以下有关分析正确的是
(Q>0),达到平衡后,改变一个条件,以下有关分析正确的是
A.升高温度,正反应速率增大,化学平衡常数增大
B.减小压强,逆反应速率减小,化学平衡常数减小
C.加入催化剂,正逆反应速率不变,平衡不移动
D.充入氧气,正反应速率先增大后减小,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁布给了三位为锂电池发展作出重要贡献的科学家,磷酸铁锂离子电池充电时阳极反应式为LiFePO4-xLi+-xe-→xFePO4+(1-x)LiFePO4。放电工作原理示意图如图。下列说法不正确的是
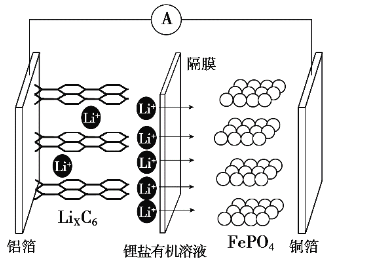
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4
D.磷酸铁锂离子电池充电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气产生NO的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是

A.曲线b对应的条件改变可能是加入了催化剂
B.温度T下,随着反应的进行,混合气体的密度减小
C.温度T下,该反应的平衡常数K =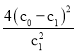
D.若曲线b对应的条件改变是温度,可判断该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是处于研究阶段的“人工固氮”的新方法。N2在催化剂表面与水发生反应:2N2(g) +6H2O(l)![]() 4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
(1)该反应平衡常数的表达式K=______________。
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡时_______。
a. 平衡常数K增大 b. H2O的浓度减小
c. 容器内的压强增大 d. v逆(O2)减小
(3)部分实验数据见下表(条件:2 L容器、催化剂、光、N21 mol、水3 mol、反应时间3 h):
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组容器中3小时内以NH3表示的平均反应速率是______________。第四组容器内NH3生成量最小的可能原因是__________________。
(4)若用该反应进行工业生产,请选择适宜的条件________________。(答两条)
(5)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量,则工业合成氨的热化学方程式是_____________________。
(6)已知:N2(g)![]() 2N(g) H2(g)
2N(g) H2(g)![]() 2H(g),则断开1 mol N-H键所需的能量是_______kJ。
2H(g),则断开1 mol N-H键所需的能量是_______kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是
A.氢氧化铝的酸式电离:Al(OH)3+H2O[Al(OH)4] —+H+
B.铜与稀硝酸的反应:Cu+4H++NO3—= Cu2+ + NO2+H2O
C.将去膜的铝片投入到NaOH溶液中:2Al+2OH—+6H2O=2[Al(OH)4]—+3H2↑
D.用碘化钾淀粉溶液检验亚硝酸钠中NO2—的存在:2NO2—+2I—+4H+=2NO↑+I2+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com