
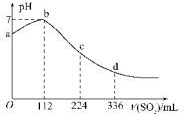
 标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )| A. | 亚硫酸是比氢硫酸更弱的酸 | |
| B. | ab段反应是:SO2+2H2S═3S↓+2H2O | |
| C. | 原H2S溶液的物质的量浓度为0.05 mol/L | |
| D. | b点对应的溶液导电性最强 |
分析 H2S 饱和溶液中通入SO2,发生反应:SO2+2H2S=3S↓+2H2O,随着反应的进行,溶液酸性逐渐减弱,但恰好反应时,溶液呈中性,二氧化硫过量,与水反应生成亚硫酸,溶液酸性逐渐增强,根据图象可知恰好反应时消耗二氧化硫112mL,根据方程式可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性更强,以此解答该题.
解答 解:A.由图象可知恰好反应时消耗二氧化硫112mL,n(SO2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,由SO2+2H2S=3S↓+2H2O可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,溶液中亚硫酸为0.01mol,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性比氢硫酸更强,故A错误;
B.ab段pH在增大,由酸性到中性,则发生的反应是SO2+2H2S=3S↓+2H2O,故B正确;
C.由图可知,112mLSO2与硫化氢恰好完全反应,则n(SO2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,由方程式可知n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为$\frac{0.01mol}{0.1L}$=0.1mol/L,故C错误;
D.b点为中性,只有水,导电性最差,故D错误;
故选:B.
点评 本题考查硫元素化合物性质、化学反应图象等,明确发生的化学反应是解答的关键,注意B选项中应根据溶液物质的浓度相等时pH大小进行判断,题目难度中等.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
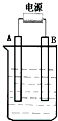 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | BaCl2溶液 | C. | Ba(OH)2溶液 | D. | Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
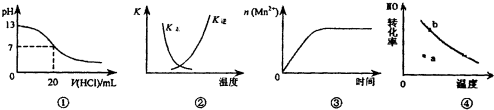
| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0,1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g):△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 图④曲线表示2NO+O2?2NO2中NO的最大转化率与温度的关系,a点表示未达到平衡状态,且v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 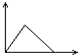 | C. | 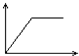 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 品红溶液:红色褪去,加热该褪色溶液,仍无色:氯气具有漂白性 | |
| B. | 紫色石蕊溶液:先变红,后褪色;氯气与水反应生成盐酸和次氯酸 | |
| C. | 含酚酞的氢氧化钠溶液:红色褪去;氯气只作氧化剂 | |
| D. | 硫化钠溶液:溶液变浑浊;氯气只作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y<Z<W | |
| B. | Z在化合物中呈+1价 | |
| C. | Y与W可形成离子化合物 | |
| D. | W的单质能在Y的单质中燃烧生成WY3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com