
【题目】我国是世界上最大的钨储藏国,金属钨可用于制造灯丝、合金钢和光学仪器,有“光明使者”的美誉;现以白钨矿(主要成分为CaWO4,还含有二氧化硅、氧化铁等杂质)为原料冶炼高纯度金属钨,工业流程如下:

已知:①钨酸酸性很弱,难溶于水;
②完全沉淀离子的pH值:SiO32-为8,WO42-为5;
③碳和金属钨在高温下会反应生成碳化钨。
回答下列问题:
(1)工业上生产纯碱常先制得碳酸氢钠,此法叫“联碱法”,为我国化工专家侯德榜创立,即向饱和食盐水中先通入NH3,再通入CO2,最终生成碳酸氢钠晶体和氯化铵溶液,写出该化学反应方程式:____________。
(2)流程中白钨矿CaWO4和纯碱发生的化学反应方程式是:________________________。
(3)滤渣B的主要成分是(写化学式)______。调节pH可选用的试剂是:_____(填选项)。
A.氨水 B.盐酸 C.NaOH溶液 D.Na2CO3溶液
(4)检验沉淀C是否洗涤干净的操作是________________________________________。
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是_________。
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中c(OH-)=_____。
【答案】NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl CaWO4+Na2CO3![]() Na2WO4+CaO+CO2↑ H2SiO3 B 取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净,若出现白色沉淀则表明沉淀未洗净。 如果用碳做还原剂,过量的碳混杂在金属中难以除去,而且碳会在高温下和金属钨反应形成碳化钨,不容易获得纯的金属钨,若用氢气作还原剂,就可避免该问题。 0.2mol/L
Na2WO4+CaO+CO2↑ H2SiO3 B 取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净,若出现白色沉淀则表明沉淀未洗净。 如果用碳做还原剂,过量的碳混杂在金属中难以除去,而且碳会在高温下和金属钨反应形成碳化钨,不容易获得纯的金属钨,若用氢气作还原剂,就可避免该问题。 0.2mol/L
【解析】
白钨矿的主要成分是CaWO4,含有SiO2、Fe2O3等杂质,白钨矿与碳酸钠在1000℃温度下反应,SiO2与Na2CO3会反应生成Na2SiO3,Fe2O3不反应,得到的混合物用水浸取,过滤后的滤液经过系列操作得到WO3,说明Na2CO3与CaWO4反应生成Na2WO4,则滤渣A为Fe2O3等,滤液中含有Na2SiO3、Na2WO4,再调节pH在5~8之间,使SiO32-转化为H2SiO3沉淀过滤除去,母液中含有Na2WO4,向其中加入盐酸得到沉淀C为H2WO4,沉淀C灼烧产生WO3和水,再还原WO3得到钨。
(1)NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl,方程式叠加得到总反应方程式;
(2)CaWO4与纯碱反应生成Na2WO4、CaO与CO2;
(3)滤渣B为硅酸,调节溶液pH使硅酸根转化为H2SiO3沉淀过滤除去,应加入酸;
(4)检验沉淀C的表面会附着NaCl,用硝酸银溶液检验最后一次洗涤液中是否含有Cl-判断;
(5)在高温下碳或氢气都可置换出W,但碳为固体,难以分离,且碳和金属钨在高温下会反应生成碳化钨;
(6) 根据Ksp(CaWO4)=c(Ca2+)×c(WO4-)计算c(Ca2+),再根据Ksp[Ca(OH)2]= c(Ca2+)×c2(OH-)计算c(OH-)。
(1)向饱和食盐水中先通入足量氨气,使溶液显碱性,然后通入CO2气体,发生反应:NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl,将两个反应方程式叠加,可得总反应方程式:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;
(2)CaWO4与纯碱在高温下反应生成Na2WO4、CaO与CO2,反应方程式为:CaWO4+Na2CO3![]() Na2WO4+CaO+CO2↑;
Na2WO4+CaO+CO2↑;
(3)滤渣B的主要成分为H2SiO3,调节溶液pH,溶液中的SiO32-与H+反应产生H2SiO3沉淀过滤除去,所以应加入盐酸,选项B合理;
(4)检验沉淀C是否洗涤干净的操作是:取最后一次的洗涤液少量于试管中,滴入1~2滴稀硝酸,再滴加1~2滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净,若出现白色沉淀则表明沉淀未洗净;
(5)如果用碳做还原剂,过量的碳混杂在金属中难以除去,而且碳会在高温下和金属钨反应形成碳化钨,不容易获得纯的金属钨,若用氢气作还原剂,由于H2是气体,就可避免上述问题;
(6)当溶液中WO42-恰好沉淀完全,其离子浓度等于10-5mol/L,根据Ksp(CaWO4)= c(Ca2+)×c(WO4-)=1×10-10,则溶液中c(Ca2+)=1×10-5mol/L,再根据Ksp[Ca(OH)2]= c(Ca2+)×c2(OH-),可知1×10-5mol/L×c2(OH-)= Ksp[Ca(OH)2]=4×10-7,所以c(OH-)=0.2mol/L。


科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiO2广泛存在自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。
(1)写出工业上制备粗硅的化学反应方程式_________________。
(2)SiO2耐腐蚀,但易溶于氢氟酸,写出化学反应方程式: ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)最大的是________(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度最大的是________。
(3)将pH相同的上述四种溶液与Zn反应生成等量氢气,所需时间最短的是_________。
(4)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=________,(写出计算式,不必计算最终结果)。温度升高,Ka将______(填“变大”、“不变”或“变小”)。
(5)在常温下将pH=11的NaOH溶液a L与pH=2的H2SO4溶液b L混合,若混合后溶液呈中性,则a:b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法一定正确的是

A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C. 在晶体中只要有阳离子就一定有阴离子
D. 晶格能:NaI>NaBr>NaCl>NaF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e-→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为
A.1.62gB.6.48gC.3.24gD.12.96g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分析某盐的成分, 做了如下实验:
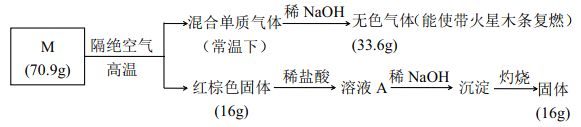
请回答:
(1)盐 M 的化学式是_________;
(2)被 NaOH 吸收的气体的电子式____________;
(3)向溶液 A 中通入H2S 气体, 有淡黄色沉淀产生, 写出反应的离子方程式________ (不考虑空气的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种装饰品的主要成分,是地壳中含量最高的两种元素形成的化合物。根据下图转化关系,回答下列问题。

(1)A的用途:________(任写一种),B是________,D是________。
(2)写出下列反应的化学方程式:①______________。
(3)写出下列反应的离子方程式:②____________,③_______,⑤____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2mol B气体在2 L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法不正确的是
2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法不正确的是
A.用物质B表示2s内的平均反应速率为0.15 mol/(L·s)
B.用物质A表示2 s内的平均反应速率为0.3 mol/(L·s)
C.2 s后物质B的浓度为0.35 mol/L
D.2 s后物质A的转化率为30%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com