
| A. | 氯化钠的电子式: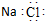 | |
| B. | 苯的结构简式:C6H6 | |
| C. | 硅的原子结构示意图: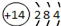 | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
分析 A.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
B.苯为平面结构,结构简式应该体现出有机物的结构特点;
C.硅原子的核电荷数=核外电子总数=14,最外层为4个电子;
D.硫酸为强电解质,电离出的氢离子不能合并.
解答 解:A.氯化钠为离子化合物,钠离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷,正确的电子式为: ,故A错误;
,故A错误;
B.C6H6为分子式,苯的结构简式为: ,故B错误;
,故B错误;
C.硅原子的核电荷数、核外电子总数为14,其原子结构示意图为: ,故C正确;
,故C正确;
D.硫酸为强电解质,溶液中完全电离,硫酸正确的电离方程式为:H2SO4=2H++SO42-,故D错误;
故选C.
点评 本题考查常见化学用语的表示方法,题目难度中等,涉及原子结构示意图、电子式、结构简式、电离方程式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | H2S溶液无法制取H2SO4 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸中,铁丝在浓硫酸中先反应完 |
| C | 离子反应总是向着某种离子浓度减小的方向进行 | 反应2Na+2CH3COOH═2Na++2CH3COO-+H2↑不能进行 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | MgCO3沉淀在水中煮沸,最终转化为Mg(OH)2沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入BaCl2溶液,再加入足量的HCl溶液,产生了白色沉淀.溶液中一定含有大量的SO42- | |
| B. | 加入足量的CaCl2溶液,产生了白色沉淀.溶液中一定含有大量的CO32- | |
| C. | 加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体.溶液中一定含有大量的NH4+ | |
| D. | 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.溶液中一定含有大量的Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
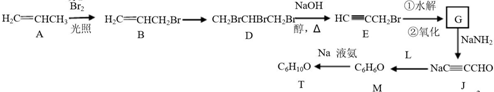
 ,则T的结构简式为
,则T的结构简式为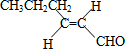 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
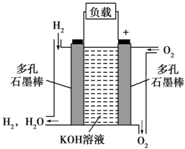 如图所示为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
如图所示为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3)2CHCH3 | C. | (CH3)2CH-CH(CH3)2 | D. | (CH3)3CCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ |

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com