
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(Lmin).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A,B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(Lmin);
(3)x的值为 .
【答案】
(1)0.75;3
(2)0.05
(3)2
【解析】解:(1)5min后,n(D)=0.5mol/L×2L═1mol,
根据3A(g)+B(g) ![]() xC(g)+2D(g),生成1molD要消耗1.5molA和0.5molB,
xC(g)+2D(g),生成1molD要消耗1.5molA和0.5molB,
设初始时A、B的物质的量均为n,则(n﹣1.5):(n﹣0.5)═3:5,即n=3.
c(A)═ ![]() ═0.75mol/L.故答案为:0.75;3; (2)v(B)═
═0.75mol/L.故答案为:0.75;3; (2)v(B)═ ![]() ═0.05mol/(Lmin),故答案为:0.05;(3)n(C)═0.1mol/(Lmin)×5min×2L═1mol,
═0.05mol/(Lmin),故答案为:0.05;(3)n(C)═0.1mol/(Lmin)×5min×2L═1mol,
n(D)=0.5mol/L×2L═1mol,
根据3A(g)+B(g) ![]() xC(g)+2D(g),n(C):n(D)═1:1,
xC(g)+2D(g),n(C):n(D)═1:1,
因为生成C和D的物质的量之比等化学计量数之比,所以n═2,故答案为:2.
(1)根据化学方程和物质的量浓度的计算式思考;(2)根据评价反应速率公式计算;(3)根据化学方程式计算.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】2018年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
① H2O(g)=H2O(l) ΔH=-A kJ·mol-1
② 2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) ΔH=+B kJ·mol-1
③ CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-C kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式________。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应。下列说法能作为判断该反应达到化学平衡状态标志的是_____________。
N2(g)+CO2(g)。某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应。下列说法能作为判断该反应达到化学平衡状态标志的是_____________。
A.活性炭的质量 B.v正(N2)=2v逆(NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变 F.容器内CO2的浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池的装置如图所示,看到b极上有红色金属析出,回答下列问题:

①若a、b是两种活动性不同的金属,则活动性a____b(填>、<或=);
②电路中的电子从____经导线流向_____(填a或b);
③溶液中的SO42-向________极移动(填a或b);
④若两电极分别是Al和C,则负极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的书写,正确的是( )
A. 氯原子的结构示意图:![]()
B. 乙烯的结构式:CH2=CH2
C. 氯化镁的电子式:![]()
D. 乙酸的分子式: CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题.
(1)Ⅰ.CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系. 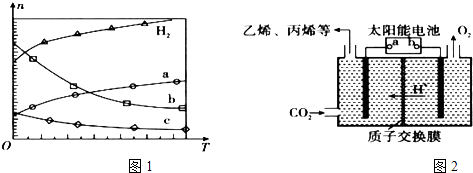
①该反应的△H0(填“>”、“=”或“<”).
②曲线b表示的物质为 .
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是 .
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示. b为电源的极,电解时,生成乙烯的电极反应式是 .
(3)Ⅱ.用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)N2(g)+CO2(g)△H=Q kJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= .
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(答一种即可).
(4)Ⅲ.工业上可以用NaOH溶液或氨水吸收过量的SO2 , 分别生成NaHSO3、NH4HSO3 , 其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32﹣)较小的是 , 用文字和化学用语解释原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时, Kb(NH3·H2O)=1.8×10-5。 该温度下,用 0.100mol·L-1 的氨水滴定 10.00 mL 0.100mol·L-1 的一元酸 HA 的溶液, 滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法不正确的是

A. HA 为强酸
B. a=10
C. 25 ℃时,NH4+的水解平衡常数为![]()
D. 当滴入 20 mL 氨水时,溶液中存在 c(NH4+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2转化为甲醇的原理为 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。500℃时,在体积为1L的固定容积的密闭容器中充入lmolCO2、3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,下列结论错误的是( )
CH3OH(g)+H2O(g) △H<0。500℃时,在体积为1L的固定容积的密闭容器中充入lmolCO2、3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,下列结论错误的是( )

A. 曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B. 从反应开始到l0min时,H2的反应速率v(H2)=0.225 mol/(L·min)
C. 平衡时H2的转化率为75%
D. 500℃时该反应的平衡常数K=3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com