
【题目】化学与人类生活、生产和社会可持续发展密切相关,下列叙述正确的是( )
A.水泥、玻璃、青花瓷、水晶、玛瑙都属于硅酸盐工业产品
B.氧化铝和氧化镁都是电解质,工业上可用于电解制取铝和镁
C.用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵都会产生温室气体
D.静电除尘、燃煤固硫、汽车尾气催化净化都可以提高空气质量
 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】某工厂的废气中含有CO、SO2、NO等有毒气体,为了更有效地治理该废气,某研究小组分别设计了如下两个方案:
方案(1):治理含CO、SO2的烟道气,以Fe2O3作催化剂,将CO、SO2在380℃时转化为S和一种无毒气体。
已知:ⅰ.硫的熔点112.8℃,沸点444.6℃;
ⅱ.反应每得到1mol硫,放出270kJ的热量。
①写出该治理烟道气反应的热化学方程式: 。
②其他条件相同,催化剂不同时,上述反应中SO2的转化率随反应温度的变化如下图。不考虑催化剂价格因素,生产中选Fe2O3作催化剂的主要原因是 。
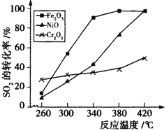
方案(2):用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) ![]() N2(g)+CO2(g)。向某容积为2L 的密闭容器中加入NO和足量的活性炭(固体试样体积忽略不计),恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。向某容积为2L 的密闭容器中加入NO和足量的活性炭(固体试样体积忽略不计),恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.32 | 0.32 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.34 | 0.34 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.17 | 0.17 |
①10min~20min以v(CO2)表示的反应速率为 。
②根据表中数据,T1℃时该反应的平衡常数为 (保留两位有效数字)。
③下列各项能作为判断该反应达到平衡状态标志的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30min时改变某一条件,反应重新达到平衡,则改变的条件可能是 ;
⑤一定温度下,随着NO的起始浓度增大,NO的平衡转化率 (填“增大”、“减小”或“不变”)
⑥50min时,保持其他条件不变,往容器中再充入0.32 mol NO和0.34mol CO2,平衡将向 方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转换的认识中不正确的是
A.电解水生成氢气和氧气时,电能转化为化学能
B.白炽灯工作时,电能全部转化为光能
C.煤燃烧时,化学能主要转化为热能
D.绿色植物进行光合作用时,太阳能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( )
A.只存在于氧气中 B.只存在于SO3中
C.只存在于SO2和SO3中 D.SO2、SO3、O2中都存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应同时又是吸热反应的是
A.Ba(OH)2·8H2O与NH4Cl反应
B.铝与盐酸反应
C.灼热的炭与CO2反应
D.甲烷与O2的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式: CuO+ Al2O3![]() CuAlO2+ ↑。
CuAlO2+ ↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 molCuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其它均为Cu,则( )

A.电极Ⅱ逐渐溶解
B.电极Ⅰ发生还原反应
C.电流方向:电极Ⅳ→A→电极Ⅰ
D.电极Ⅲ的电极反应:Cu2+ + 2e- = Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)![]() CO(g)+H2(g);
CO(g)+H2(g);
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)═CO2(g);△H=﹣393.5kJmol﹣1
H2(g)+![]() O2(g)═H2O(g);△H=﹣242.0kJmol﹣1
O2(g)═H2O(g);△H=﹣242.0kJmol﹣1
CO(g)+![]() O2(g)═CO2(g);△H=﹣283.0kJmol﹣1
O2(g)═CO2(g);△H=﹣283.0kJmol﹣1
请回答:(1)根据以上数据写出C(s)与水蒸气反应的热化学反应方程式: .
(2)比较反应热数据可知,1mol CO(g)和1mol H2(g)完全燃烧放出的热量之和比1mol C(s)完全燃烧放出的热量多.甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出右面循环图:并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”.请分析:甲、乙两同学观点正确的是 (填“甲”或“乙”);判断的理由是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )

A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 简单离子半径:T>R
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com