
| A、1.0×10-3mol?L-1盐酸的pH=3,1.0×10-8mol?L-1盐酸的pH=8 |
| B、pH=a的醋酸溶液稀释l倍后,溶液的pH=b,则a>b |
| C、pH=12的氨水和pH=2的盐酸等体积混合,混合液的pH<7 |
| D、1mLpH=l的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |


科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | H2O2、SO2都能使酸性高锰酸钾褪色 | 两者在反应中均表现还原性 |
| B | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
| C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| D | 铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸 | 铁和铝不能与浓硫酸或浓硝酸反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 如图可表示水分解过程中的能量变化 |
| B、任何能使熵值减小的过程都能自发进行 |
| C、需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D、已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1molH-Cl键所需的能量为-a-b-c |
查看答案和解析>>
科目:高中化学 来源: 题型:
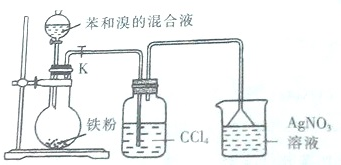
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g C2H4中含有2NA个碳原子 |
| B、高温高压下,28gN2与6gH2反应,生成的NH3分子数为2NA |
| C、500mL 2mol?L-1的AlCl3溶液中所含Al3+的数目为NA |
| D、1mol乙基(-C2H5)中含有的电子数为16NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
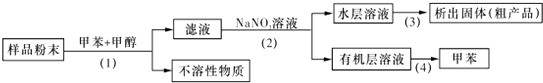
| A、步骤(1)需要用到玻璃棒 |
| B、步骤(2)需要用到分液漏斗 |
| C、步骤(3)需要用到坩埚 |
| D、步骤(4)需要用到温度计 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性 | B、还原性 |
| C、酸性 | D、碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com