
【题目】Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
实验Ⅰ 配制500 mL 一定浓度的Na2SO3溶液
①溶解:准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是____
②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为 __,同时洗涤____(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2 cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
实验Ⅱ 探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(1)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式 ____;
②提出假设二的可能依据是_____;
③验证假设三是否成立的实验操作是____。
(2)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:
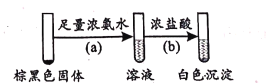
①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为____;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是____(写化学式)。
(3)由上述实验可知,盐溶液间的反应存在多样性。经验证,(1)中实验假设一成立,则(2)中实验的产物不同于(1)实验的条件是 ___。
【答案】去除蒸馏水中的氧气,防止亚硫酸钠被氧化 500 mL容量瓶 烧杯、玻璃棒 SO32-+2Ag+= Ag2SO3 Na2SO3被酸化的NO3-氧化成Na2SO4,Na2SO4与AgNO3溶液反应生成Ag:2SO4沉淀 取固体少许加入足量 Na2SO3溶液(或向试管中继续滴加Na2SO3溶液) Ag2O + 4NH3·H2O =2Ag(NH3)2OH + 3H2O或Ag2O+4NH3+H2O=2Ag(NH3)2OH AgOH Na2SO3溶液滴加顺序不同 (或用量不同) ,溶液酸碱性不同(或浓度不同)
【解析】
配置一定物质的量浓度的溶液时,
①溶解时:Na2SO3晶体易被溶液中溶解的氧气氧化,故需煮沸;
②移液时:配置一定物质的量浓度的溶液时需要使用容量瓶,移液时需要洗涤烧杯和玻璃棒;
实验Ⅱ 探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
①假设一是银离子与亚硫酸根离子反应生成亚硫酸银;
②考虑加入的酸性的硝酸银溶液具有氧化性,将亚硫酸银氧化成硫酸银;
③由于Ag2SO3溶于过量Na2SO3溶液,可以加入Na2SO3溶液验证溶液中是否有Ag2SO3;
(2) ① Ag2O为棕黑色固体,与氨水反应生成Ag(NH3)2OH和 3H2O;
②从非氧化还原反应分析得化合价不变,判断A的成分;
(3) (1)中实验和(2)中实验中溶液的滴加顺序不同,溶液酸碱性不同。
①溶解时:Na2SO3晶体易被溶液中溶解的氧气氧化,故需煮沸,防止亚硫酸钠被氧化;
②移液时:配置一定物质的量浓度的溶液时需要使用500ml的容量瓶,移液时需要洗涤烧杯和玻璃棒2~3次;
(1)①假设一是银离子与亚硫酸根离子反应生成亚硫酸银SO32-+2Ag+= Ag2SO3;
②将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,酸性溶液中存在氢离子,氢离子和硝酸根相当于硝酸,具有氧化性,可能会将亚硫酸根离子氧化成硫酸根;
③.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液,故可以加入过量Na2SO3溶液,看是否继续溶解,若继续溶解一部分,说明假设三成立;
(2) ①Ag2O,棕黑色固体,不溶于水,可与浓氨水反应,反应a为Ag2O + 4NH3·H2O =2Ag(NH3)2OH + 3H2O;
②将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,由于亚硫酸银易溶于亚硫酸钠,故生成的白色沉淀不是亚硫酸银,溶液呈碱性,也不是硫酸银,银离子在碱性条件下,例如银离子和氨水反应可以生成氢氧化银,是白色沉淀,A为AgOH;
(3)实验(1)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,实验(2)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,对比两次实验可以看出,滴加顺序不同(或用量不同),,所给盐溶液酸碱性不同(或浓度不同)。


科目:高中化学 来源: 题型:
【题目】下面是几种实验中常用的仪器
A![]() B
B C
C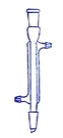 D
D![]()
(1)写出下列代号所代表的仪器的名称:C___________;D___________
(2)分离水和四氯化碳可选用的仪器________ (填仪器代号)。
(3)操作时怎样才能使C仪器中装满所需的水?____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷高温裂解的产物有甲烷、乙烷、乙烯、丙烯 4 种气体,当丁烷完全分解时,所得裂解气的平均式量为 ( )
A.58B.43.5C.29D.14.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知所用火箭推进剂为肼(N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。请回答下列问题:
(1)NH3、H2O2分子中电负性最大的元素在周期表中的位置为___,第一电离能最大的元素为___。
(2)铬的原子序数为24,其基态电子排布式为___。
(3)1molN2H4分子中含有的σ键数目为___。
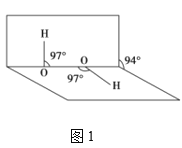
(4)H2O2分子结构如图1,其中心原子杂化轨道类型为___,估计它难溶于CS2,简要说明原因___。
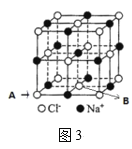
(5)氮化硼晶胞如图2所示,处于晶胞顶点上的原子的配位数为___,若立方氮化硼的密度为ρgcm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为___cm。
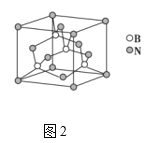
(6)如图3所示,若将A离子移到晶胞的体心,则B离子移到了___(填顶点,面心或棱心)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验事实:
(1)X+Y2+=X2++Y;(2)Z+2H2O![]() Z(OH)2+H2↑;(3)Z2+离子的放电能力比X2+弱;(4)由Y、W 作电极组成的原电池反应为:Y-2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
Z(OH)2+H2↑;(3)Z2+离子的放电能力比X2+弱;(4)由Y、W 作电极组成的原电池反应为:Y-2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
A. X > Y > Z > WB. Y > X > W > Z
C. Z > X > Y > WD. Z > Y > X > W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时CuSO4的溶解度是Sg,其饱和溶液密度为dg·cm-3,物质的量浓度为cmol·L-1。向足量饱和溶液中加入mg无水CuSO4或蒸发掉ng水后恢复t℃,均能获得Wg胆矾晶体,下列关系式正确的是
A. c=![]() mol·L-1 B. S=
mol·L-1 B. S=![]() g
g
C. m=![]() g D. W=
g D. W=![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列

表述中正确的是
A.反应的化学方程式为2X = 3Y + Z
B.t时,正、逆反应都不再继续进行,反应达到化学平衡
C.若t=4,则0~t的X的化学反应速率为0.1 molL-1min-1
D.温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图的说法不正确的是( )
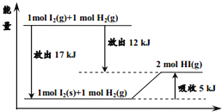
A. 1mol固态碘与![]() 化合生成2molHI气体时,需要吸收5kJ的能量
化合生成2molHI气体时,需要吸收5kJ的能量
B. 2molHI气体分解生成1mol碘蒸气与![]() 时需要吸收12kJ的能量
时需要吸收12kJ的能量
C. 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D. 碘蒸气与![]() 生成HI气体的反应是吸热反应
生成HI气体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验过程中,下列溶液的导电能力变化不大的是
A. ![]() 溶液中滴入
溶液中滴入![]() 溶液至过量
溶液至过量
B. 醋酸溶液中滴入氨水至过量
C. 澄清石灰水中通入![]() 至过量
至过量
D. ![]() 溶液中加入适量的NaOH固体
溶液中加入适量的NaOH固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com