
分析 n(O2)=$\frac{8.96L}{22.4L/mol}$=0.4mol,燃烧后气体的物质的量为n=$\frac{6.72L}{22.4L/mol}$=0.3mol,通过足量碱石灰吸收后剩余2.24L,即n=$\frac{2.24L}{22.4L/mol}$=0.1mol,如氧气过量,则剩余气体为氧气,如氧气不足,则剩余气体为CO,以此解答该题.
解答 解:(1)通过足量碱石灰吸收后剩余2.24L,如氧气过量,则剩余气体为氧气,如氧气不足,则剩余气体为CO,故答案为:O2;CO;
(2)若A是烃,如氧气过量,则生成二氧化碳为0.3mol-0.1mol=0.2mol,消耗氧气为0.4mol-0.1mol=0.3mol,设烃中H原子数为y,则2+$\frac{y}{4}$=3,y=4,为C2H4,
如氧气不足,燃烧后6.72L气体为二氧化碳和一氧化碳,可知1mol烃含有3molC原子,可能为C3H6或C3H8,方程式为C3Hy+4O2=2CO2+CO+$\frac{y}{2}$H2O,
则y=6,应为C3H6,
若A是烃的衍生物,设其化学式为CxHyOz,
如氧气过量,则生成二氧化碳为0.3mol-0.1mol=0.2mol,消耗氧气为0.4mol-0.1mol=0.3mol,由以上解答可设分子式为C2H4•(H2O)m,m=1符合,为C2H6O,
如氧气不足,燃烧后6.72L气体为二氧化碳和一氧化碳,可知1mol烃含有3molC原子,可设分子式为C3H6•(H2O)n,n=1符合,为C3H8O,
故答案为:C2H4;C3H6;C2H6O;C3H8O.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析、计算能力的考查,题目难度中等,注意从质量守恒的角度解答该类题目,结合方程式计算.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
氧族元素包括氧、硫、硒、碲、钋等,如图为氧族元素氢化物a、b、c、d的生成热数据示意图,下列关于氧族元素的说明正确的
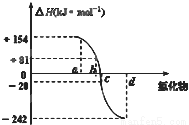
A.含有18e-的两种氢化物中只存在极性键
B.氢化物的沸点大小是H2O<H2S<H2Se<H2Te
C.a所对应的氢化物是H2O
D.每1mol H2S分解会吸收20KJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
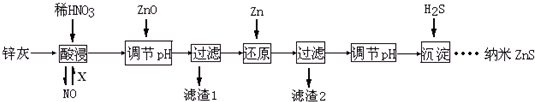
| A. | 酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++NO${\;}_{3}^{-}$═3Fe3++NO↑+5H2O | |
| B. | 将酸浸的尾气循环利用,加入的X气体可以是O2 | |
| C. | 滤渣2中的成分和Zn和Fe | |
| D. | 当溶液中Zn2+浓度为小于1.0×10-5mol•L-1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2-浓度应大于1.6×10-19mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 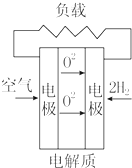 固体氧化物燃料电池 | B. | 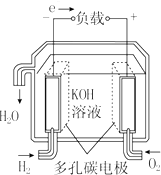 碱性燃料电池 | ||
| C. | 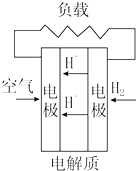 质子交换膜燃料电池 | D. | 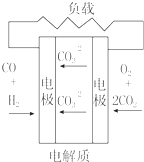 熔融盐燃料电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe3O4 | ||
| C. | Fe2O3 | D. | Fe3O4 和Fe2O3混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式未注明温度和压强时,△H表示标准状况下的数据 | |
| B. | 热化学方程式中各物质前的化学计量数不表示分子个数,只代表物质的量 | |
| C. | 同一化学反应,化学计量数不同,△H不同;化学计量数相同而状态不同,△H也不相同 | |
| D. | 化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
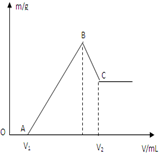 将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示.
将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为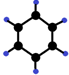 |
| C | ①由C、H、O三种元素组成;②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2;②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com