
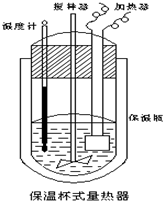
 在如图所示的量热计中,将100mL 0.50mol?L-1CH3COOH溶液与100mL0.55mol?L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J?℃-1生成溶液的比热容为4.184J?g-1?℃-1,溶液的密度均近似为1g?mL-1.
在如图所示的量热计中,将100mL 0.50mol?L-1CH3COOH溶液与100mL0.55mol?L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J?℃-1生成溶液的比热容为4.184J?g-1?℃-1,溶液的密度均近似为1g?mL-1.| [150.5J/K+4.184J?(g?K)-1×200g]×(27.7-25)K |
| 0.05mol |


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000mL,212g |
| B、950mL,543.4g |
| C、任意规格,572g |
| D、500mL,286g |
查看答案和解析>>
科目:高中化学 来源: 题型:
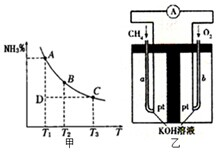 运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义.
运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义.| c(H+) |
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在NaAlO2溶液中加入过量盐酸溶液 |
| B、在AlCl3溶液中加入过量氨水 |
| C、在AlCl3溶液中加入过量NaOH溶液 |
| D、用Al2O3与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com