
| A. | ①②③④ | B. | ①③ | C. | ①②③ | D. | ①② |
分析 结合n=$\frac{m}{M}$、c=$\frac{n}{V}$及稀释前后溶质的物质的量不变计算.
解答 解:①将14.2gNa2SO4溶于适量水中配成100mL溶液,n=$\frac{14.2g}{142g/mol}$=0.1mol、c=$\frac{0.1mol}{0.1L}$=1.0mol/L,故正确;
②将32.2gNa2SO4.10H2O溶于少量水中,再用水稀释至100mL,n=$\frac{32.2g}{322g/mol}$0.1mol、c=$\frac{0.1mol}{0.1L}$=1.0mol/L,故正确;
③将20ml5.0mol/LNa2SO4溶液用水稀释至100mL,则c=$\frac{0.02L×5.0mol/L}{0.1L}$=0.1mol/L,故正确;
④将14.2gNa2SO4溶于100mL水中,水为溶剂,溶液体积未知,不能计算c,故错误;
故选C.
点评 本题考查物质的量浓度及溶液配制,为高频考点,把握物质的量、质量、浓度的关系为解答该题的关键,侧重分析与计算能力的考查,注意溶液体积的判断,题目难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:NH4+、MnO4-、SO42-、CO32- | |
| B. | 在含大量 Ba2+的溶液中:NH4+、Na+、Cl-、OH- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在 pH=1 的溶液中:K+、Fe2+、Cl-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 →
→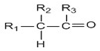
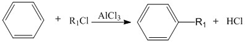
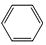 +R1Cl$\stackrel{AlCl_{3}}{→}$
+R1Cl$\stackrel{AlCl_{3}}{→}$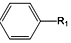 +HCl
+HCl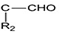 +H2O(R1、R2、R3代表烃基或氢原子)回答下列问题:
+H2O(R1、R2、R3代表烃基或氢原子)回答下列问题: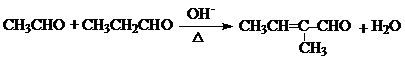 .
.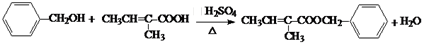 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O | B. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | ||
| C. | NaCl+AgNO3═NaNO3+AgCl↓ | D. | Zn+CuSO4═Cu+ZnSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯是一种用途广泛的有机原料,可制备多种化工产品.
乙苯是一种用途广泛的有机原料,可制备多种化工产品. +Cl2(g)$\stackrel{催化剂}{?}$
+Cl2(g)$\stackrel{催化剂}{?}$ -CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:
-CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△H=+124kJ/mol
=CH2(g)+H2(g)△H=+124kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
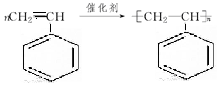
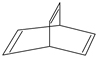 有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为
有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为 有一种有机物X的键线式如图所示.
有一种有机物X的键线式如图所示. .
. .
.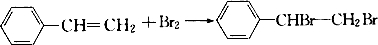 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用小苏打(NaHCO3)发酵面团制作馒头 | |
| B. | 光导纤维的主要成分是SiO2 | |
| C. | 干燥的氯气和液氯均能使干燥的有色布条褪色 | |
| D. | 用Al(OH)3治疗胃酸过多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com