
下列关于实验Ⅰ~Ⅳ的说法正确的是
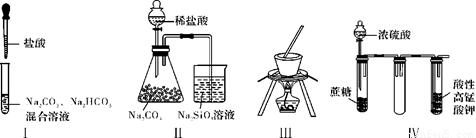
A. 实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡
B. 实验Ⅱ:通过实验现象可比较氯、碳、硅三种元素的非金属性强弱
C. 实验Ⅲ:本装置可以用于从饱和食盐水制取NaCl晶体
D. 实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江苏省高二学业水平测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 1molN2中含有的分子数为2×6.02×1023
B. 用激光笔照射CuSO4溶液可产生“丁达尔效应”
C. 常温下,铝片能溶于浓硝酸
D. 常温下,淀粉溶液遇I2变成蓝色
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:实验题
某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。
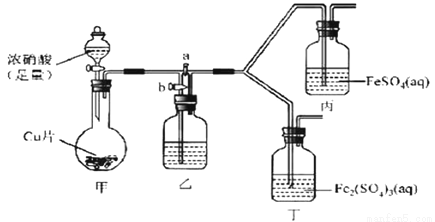
Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论,正确的是
选项 | 实验操作及现象 | 结论 |
A | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大 | 作金属性:S>C |
B | 向CH2=CHCH2OH中滴加酸性KMnO4溶液,紫红色褪色 | CH2=CHCH2OH 中含有碳碳双键 |
C | 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1CuSO4溶液,沉淀变为浅蓝色 | 同温下,Ksp[Mg(OH)2]> Ksp[Cu(OH)2] |
D | 将某化合物在酒精灯上进行焰色反应,透过蓝色钴玻璃观察为紫色 | 该化合物一定是钾盐 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三下学期周练(四)理科综合化学试卷(解析版) 题型:填空题
二氧化碳和氨是重要的化工产品,是纯碱工业、制造硝酸、铵盐和氮肥等的原料。
(1)CO2的电子式是 。
(2)以NH3与CO2为原料合成尿素[化学式为CO(NH2)2]的主要反应如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③ H2O(1) = H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如下图1所示,由此图可知温度对NO产率的影响规律为 ,请用化学反应速率和化学平衡理论解释其原因: 。
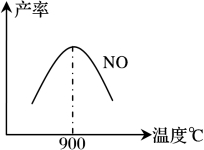
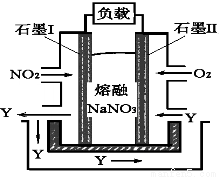
图1 图2
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关石墨I电极反应可表示为_______________。
(5)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。 常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显__________(填“酸性”、“中性”或“碱性”);计算反应NH4++HCO3—+H2O NH3·H2O+H2CO3的平衡常数K= (结果保留2位有效数字)。
NH3·H2O+H2CO3的平衡常数K= (结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:简答题
2015年10月,中国科学家坩呦呦获得了2015年度诺贝尔生理学或医学奖,获奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特別是发展中国家的数百万人的生命”。已知青蒿素的一种化学合成方法的部分工艺流程如图24:
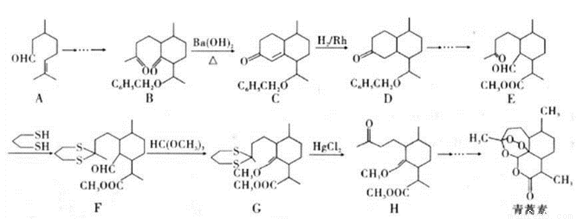
已知:①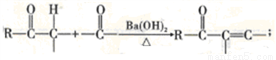
②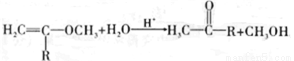
请冋答下列问题:
(1)下列有关说法正确的是_______(填序号)。
A.青蒿素属于环状化合物,但不属于芳香族化合物
B.青蒿素易溶于水,难溶于乙醇、苯等
C.一定条件下,青蒿素能与氢氧化钠溶液反应
D.青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基
(2)化合物A中含有的非含氧官能团的名称是_______,请选择下列合适的试剂来检验该官能团,试剂加入的正确顺序为____。
A.溴水 B.稀盐酸
C.新制氢氧化铜悬浊液 D.氢氧化钠溶液
(3)该工艺流程中设计E→F、G→H的目的是_________________。
(4)H与稀硫酸共热时反应的化学方程式为_____________________。
(5)M与A互为同系物,但比A少两个碳原子。满足下列条件的M的同分异构体有______种(不考虑立体异构)。
①含有六元环 ②能发生银镜反应
(6)请结合所学知识和上述信息,写出以笨甲醛和氯乙烷为原料,制备苄基乙醛(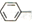 CH2CH2CHO)的路线流程图。_______________________(无机试剂任选,合成路线流程图示例如下:
CH2CH2CHO)的路线流程图。_______________________(无机试剂任选,合成路线流程图示例如下: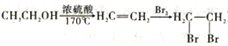 )
)
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:选择题
短周期A、B、C、D、E五种主族元素,原子序数依次增大,B、C、E最外层电子数之和为11,A原子最外层电子数是次外层电子数的2倍,C是同周期中原子半径最大的元素,工业上一般通过电解氧化物的方法获得D的单质,E单质是制备太阳能电池的重要材料。下列说法正确的是
A. 相同质量的C和D单质分別与足量稀盐酸反应时,后者生成的氢气多
B. C与D的最高价氧化物对应的水化物的碱性相比,后者更强
C. 不用电解氯化物的方法制备单质D是由于其氯化物的熔点高
D. 简单离子半径:B<C
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列化学用语表达正确的是( )
A.HCl的电子式为H+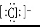 B.S2-的结构示意图为
B.S2-的结构示意图为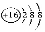
C.O-16原子的符号为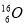 D.
D.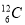 、
、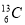 、
、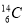 含有相同的中子数
含有相同的中子数
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:选择题
下列关于有机化合物的结构、性质的叙述正确的是( )
A. 糖类、油脂、蛋白质的水解产物都是非电解质
B. 淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体
C. 纤维素、甘油分别在浓硫酸存在时与浓硝酸的反应属于同一类型的反应
D. 乙醇、乙酸和苯酚的分子中均含有官能团—OH,所以均能与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com