
下列说法正确的是( )
A. 某试样焰色反应呈黄色,则试样中可能含有K+
B. 广泛pH试纸测得某新制氯水的pH为4
C. 配制240mL某溶液,应选240mL容量瓶
D. 可用排饱和食盐水来收集纯净的氯气
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:填空题
[选修3:物质结构与性质]
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有____________种;写出Cu+的核外电子排布式____________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有_________种,属于d区的元素有____________种。
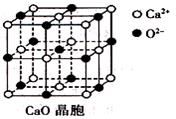
(3)CaO晶胞如下图所示,CaO晶体中Ca2+的配位数为____________;
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是________(填选项字母)。
A.NaN3与KN3结构类似,前者晶格能较小 |
B.晶体钾的晶胞结构如图所示: |
C.氮的第一电离能大于氧 |
D.氮气常温下很稳定,是因为氮的电负性小 |
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为___________,CNO-的中心原子的杂化方式为___________。
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+。
将含0.0015mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol/LNaOH溶液25.00 mL,则该配离子的化学式为_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:选择题
已知相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断 裂时需要吸收的能量/kJ | 436 | 230 | 369 |
H2(g)+Br2(g)=2HBr(g) ΔH=-akJ/mol则a是
A.404 B.72 C.230 D.200
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
某温度下,关于①0.01mol·L-1醋酸溶液,②pH=2醋酸溶液,下列说法正确的是( )
A.c(CH3COOH):①>②
B.c(CH3COO-):①>②
C.c(CH3COOH)+c(CH3COO-):①=②
D.c(CH3COO-)+c(OH-):①<②
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
如图是部分短周期元素主要化合价与原子序数的关系图,下列说法不正确的是( )
A. X和W位于同一主族
B. 原子半径:Y>Z>X
C. 盐YRX与化合物WX2的漂白原理相同
D. Y和R两者的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
下列属于氧化还原反应的是( )
A.2KI+Br2 =2KBr+I2
B.CaCO3 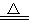 CaO+CO2↑
CaO+CO2↑
C.SO3+H2O = H2SO4
D.MgCl2+2NaOH = Mg(OH)2↓+NaCl
查看答案和解析>>
科目:高中化学 来源:2017届四川省绵阳市高三上学期第一次月考化学试卷(解析版) 题型:实验题
某学生欲配制6.0mol/L的H2SO41 000mL,实验室有三种不同浓度的硫酸:①480mL 0.5mol/L 的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸.有三种规格的容量瓶:250mL、500mL、1 000mL.老师要求把①②两种硫酸全部用完,不足的部分由③来补充.
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为 mol/L(保留1位小数).
(2)配制该硫酸溶液应选用容量瓶的规格为 mL.
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整.
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸 mL,沿玻璃棒倒入上述混合液中.并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D. ;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm 处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀.
(4)如果省略操作D,对所配溶液浓度有何影响定容时,俯视刻度线,对所配溶液浓度有何影响 (填“偏大”、“偏小”或“无影响”).
(5)进行操作C前还需注意 .
查看答案和解析>>
科目:高中化学 来源:2017届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:选择题
二氧化硫的催化氧化原理为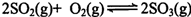 ,反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
,反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
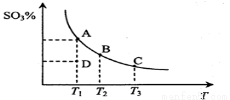
A.在D点时v正<v逆
B.反应2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
C.若B、C点的平衡常数分别为KB、KC,则KB> KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列实验中,对应的现象以及实验目的都正确的是( )
选项 | 目的 | 实验 | 现象 |
A | 检验CO2气体中混有SO2 | 将气体通入盛有足量的澄清石灰水中的洗气瓶中 | 石灰水变浑浊 |
B | 检验黑色固体Fe3O4中含有+3价铁元素 | 将少量黑色固体加入盛有KSCN溶液的烧杯中 | 固体溶解,溶液呈血红色 |
C | 比较氯和碳的非金属性强弱 | 将碳酸钠溶液中滴入稀盐酸 | 有气泡产生 |
D | 验证氧化性:Fe3+>Cu2+ | 将一定量铜粉加到盛有一定体积的1.0mol•L﹣1Fe2(SO4)3溶液的试管中 | 铜粉溶解,溶液变蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com