
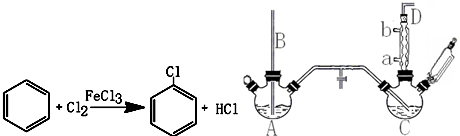
���� ��1��������B����Һ���£�װ����ѹǿ����ʱ����������ƽ����ѹ����ȡ����ԭ��ͨ������ˮ��
��2���ٷ�Ӧ��C���ȿ��Ʒ�Ӧ�¶���40-60�棬Ӧ����ˮԡ���ȣ�
�����ڱ��ӷ�����Ӧ������HCl������δ��Ӧ��������������D���ڵ�����
��3�������Ȼ������������Ʒ�Ӧ�����ɵ�HCl�����������Ʒ�Ӧ���ܽ������Ҳ����ȥ�����Ʒ�Ӧ��
��4��A��C��Ӧ��֮����Ҫ��������װ�ã��������ɵ������������������������Ȼ��Ƶȣ�
��� �⣺��1��������B����Һ���£�װ����ѹǿ����ʱ����������ƽ����ѹ����ȡ����ԭ��ͨ������ˮ��ʹ�����ܳ�������ˮ�������ȴ��������ˮ��a�����룬��b��������
�ʴ�Ϊ��ƽ����ѹ��a��
��2���ٷ�Ӧ��C���ȿ��Ʒ�Ӧ�¶���40-60�棬Ӧ����ˮԡ���ȣ�
�ʴ�Ϊ��c��
�����ڱ��ӷ�����Ӧ������HCl������δ��Ӧ��������D���������к���HCl����������������
�ʴ�Ϊ����������������
��3���ڴ����Ȼ������������Ʒ�Ӧ������HCl�����������Ʒ�Ӧ���ܽ������Ҳ����ȥ�����Ʒ�Ӧ����Ӧ����ʽΪ��FeCl3+3NaOH=Fe��OH��3��+3NaCl��HCl+NaOH=NaCl+H2O��Cl2+2NaOH=NaCl+NaClO+H2O��
�ʴ�Ϊ��FeCl3+3NaOH=Fe��OH��3��+3NaCl��HCl+NaOH=NaCl+H2O�ȣ�
��4��A��C��Ӧ��֮����Ҫ����U�ܣ��������ɵ������������������������Ȼ��Ƶȣ�
�ʴ�Ϊ�������������Ȼ��ƣ�
���� ���⿼���л����Ʊ�ʵ�鷽������Ŀ�Ѷ��еȣ��漰��װ�á�������ԭ���ķ������۵�֪ʶ����ȷʵ��Ŀ�ġ�ʵ��ԭ��Ϊ���ؼ�������������ѧ���ķ�����������ѧʵ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
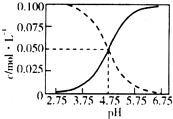 25��ʱ��c��CH3COOH��+c��CH3COO-��=0.1mol•L-1�Ĵ��ᡢ�����ƻ����Һ�У�c��CH3COOH����c��CH3COO-����pH�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ�������
25��ʱ��c��CH3COOH��+c��CH3COO-��=0.1mol•L-1�Ĵ��ᡢ�����ƻ����Һ�У�c��CH3COOH����c��CH3COO-����pH�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ�������| A�� | 25��ʱ��CH3COOH�ĵ��볣��K��ֵ5��10-2.75 | |
| B�� | ��pH����$\frac{c��C{H}_{3}COOH��}{c��C{H}_{3}CO{O}^{-}��}$���� | |
| C�� | pH=4����Һ�У�c��CH3COO-����c��CH3COOH����c��H+����c��OH-�� | |
| D�� | pH=5����Һ�У�c��H+��+c��Na+��+c��CH3COOH��-c��OH-��=0.1 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| Ԫ�ش��� | A | B | C | D | E |
| ԭ�Ӱ뾶/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| ��Ҫ���ϼ� | +1 | +3 | +2 | +6��-2 | -2 |
| A�� | BԪ�ز����γɹ��ۻ����� | |
| B�� | ���Ӱ뾶��СA+��D2- | |
| C�� | A��E�γɵĻ�������ֻ���ܺ����Ӽ� | |
| D�� | B��E�Ļ����ﲻ�����ڰ�ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
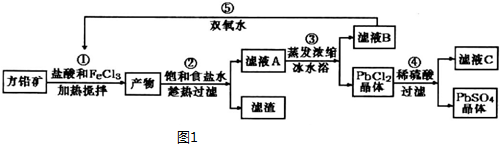
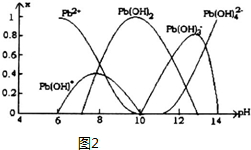
| ���� | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| ����ǰŨ��/��mg•L-1�� | 0.100 | 29.8 | 0.12 | 0.087 |
| ������Ũ��/��mg•L-1�� | 0.004 | 22.6 | 0.04 | 0.053 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����Ԫ�صķ�����O��
����Ԫ�صķ�����O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
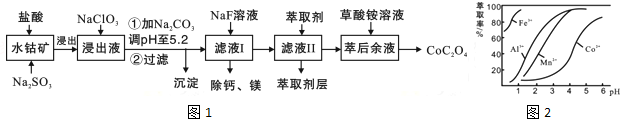
| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | Mn��OH��2 |
| ��ȫ������pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
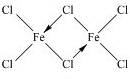 ������Ϊ�÷����Ƿ�Ϊƽ���η��ӣ�����ǡ�����
������Ϊ�÷����Ƿ�Ϊƽ���η��ӣ�����ǡ�����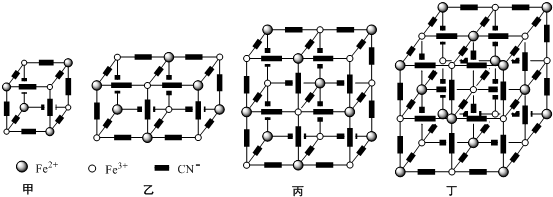
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com