
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
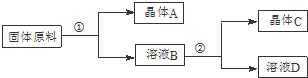
分析 由表中数据可知NaCl溶解度最小,用物质的量之比为1:1的硝酸钠和氯化钾为原料,加水溶解,由分离流程可知,在①的实验过程中,将硝酸钠和氯化钾加水溶解,蒸发浓缩,有NaCl析出,滤液B为硝酸钾,蒸发浓缩,将滤液冷却可使硝酸钾析出,以此来解答.
解答 解:由表中数据可知NaCl溶解度最小,用物质的量之比为1:1的硝酸钠和氯化钾为原料,加水溶解,由分离流程可知,在①的实验过程中,将硝酸钠和氯化钾加水溶解,蒸发浓缩,有NaCl析出,滤液B为硝酸钾,蒸发浓缩,将滤液冷却可使硝酸钾析出,
(1)硝酸钠和氯化钾不同温度下溶解度不同,控制温度可使其析出,将硝酸钠和氯化钾加水溶解,蒸发浓缩,有氯化钠析出,A为氯化钠,过滤分离出氯化钠,将滤液冷却可使硝酸钾析出,C为硝酸钾,故答案为:控制温度;C;
(2)在①的实验过程中,将硝酸钠和氯化钾加水溶解,蒸发浓缩,有氯化钠析出,趁热过滤分离出氯化钠,
故答案为:加水溶解;蒸发浓缩;趁热过滤;
(3)产品中可能仍含少量的NaCl,即Na+、Cl-;Na+利用焰色反应;Cl-用AgNO3溶液和稀硝酸检验,操作方法是用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,证明有Cl-,
故答案为:Na+、Cl-;用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,证明有Cl-;
(4)根据溶解度表,则硝酸钾在低温和95%的酒精溶解度表比较小,又杂质离子易溶于水和酒精溶液,所以洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是bc,故选:bc.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及流程中的混合物分离方法解答本题的关键,侧重分析与应用能力的考查,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
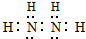 .
. HCO3-+OH-. 0.2mol/L该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
HCO3-+OH-. 0.2mol/L该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2和HBrO3均是氧化产物 | |
| B. | BrF3既是氧化剂,又是还原剂 | |
| C. | BrF3的氧化性强于O2 | |
| D. | 反应中,若生成1molBr2,则反应转移6NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能kJ/mol | 436 | 565 | 431 | 368 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 试剂③是AgNO3溶液,试剂⑤是稀硝酸,现象1中白色沉淀是AgCl | |
| B. | 现象3中白色沉淀是BaSO4 | |
| C. | 产生现象2的离子方程式是:Br2+2H2O+SO2═4H++2Br-+SO42- | |
| D. | 试剂②是稀盐酸,试剂③是稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )的流程:
)的流程: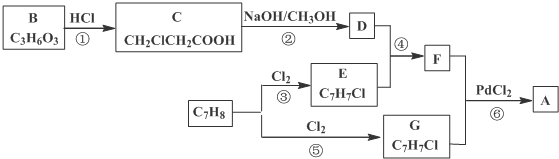
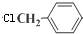
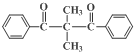 、、
、、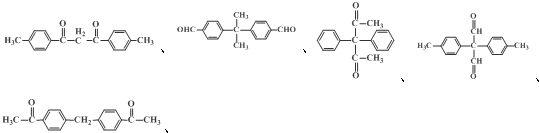 (其中两种).
(其中两种). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com