
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
分析 (1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高;
(2)实验Ⅱ中加入10滴饱和MnSO4溶液做催化剂,则实验Ⅰ和Ⅱ探究的是催化剂对反应速率影响;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同;
(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,少量蒸馏水,确保溶液的体积相同.
解答 解:(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高,MnO4-为氧化剂,H2C2O4为还原剂,则反应中氧化剂和还原剂的物质的量之比为2:5,
故答案为:2:5;
(2)实验Ⅰ和Ⅱ中硫酸体积、温度相同,只有催化剂不同,则探究的是催化剂对反应速率的影响;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同,则选实验Ⅰ、Ⅲ,
故答案为:催化剂;Ⅲ;
(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,可研究浓度对反应速率的影响,加少量蒸馏水确保两实验中总体积相等,确保Ⅰ和Ⅳ中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同,
故答案为:确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同.
点评 本题考查探究影响反应速率的因素,题目难度不大,注意控制变量法研究影响因素,把握表格中的数据分析及应用,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 碳酸钠水解的离子方程式:CO32-+2H2O?OH-+H2CO3 | |
| C. | CH3COOH的电离方程式为:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 次氯酸的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去混在Cu粉中的少量Mg粉和Al粉,加稀盐酸后过滤 | |
| B. | 分离汽油和煤油,可用萃取的方法 | |
| C. | 分离硝酸钾和氯化钠固体的混合物,可用溶解、过滤的方法 | |
| D. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
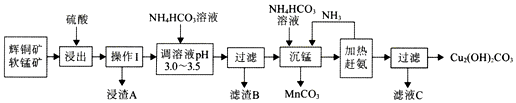
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
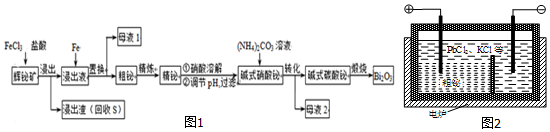
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
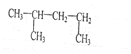
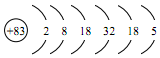
| A. | ②⑤⑥ | B. | ②④ | C. | ④⑤ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑火药由硝石、硫磺、木炭按一定比例混合制成,其中“硝石”指的是硝酸钾 | |
| B. | “青篙一握,以水二升渍,绞取汁”,该挺取青蒿素的过程属于化学变化 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合反应 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
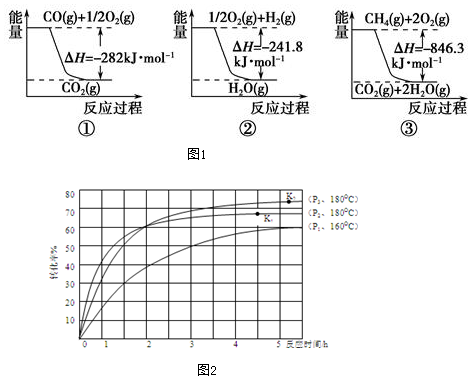
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
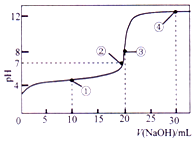 常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 点③所示溶液中:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | 点④所示溶液中:2c(OH-)-2c(H+)=c(CH3COO-)+3c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com