
下列关于Na2CO3和NaHCO3性质的说法错误的是 ( )
A.热稳定性:NaHCO3<Na2CO3
B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3
C.相同温度时,在水中的溶解性:NaHCO3<Na2CO3
D.等物质的量浓度溶液的pH:NaHCO3<Na2CO3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
探究式课堂教学由于注重知识的形成过程而很好地体现了新课改的理念。某班在学习“过氧
化钠的性质”时,该班同学进行了以下两个实验:

(1)提出问题
实验一的CO2能灭火,实验二的CO2为何能“点火”?
(2)假设与猜想
①Na2O2与CO2发生了反应,可能有Na2CO3生成;
②棉花燃烧,说明该反应放热,使温度达到了棉花的着火点;
③剧烈燃烧,反应中可能有 生成。
(3)设计并进行实验,观察、解释和结论
请你帮助他们完成下表:
| 实验步骤 | 实验现象 | 原因和结论 | ||
| Ⅰ | 用小矿泉水瓶收集满CO2,再向瓶中加入不同量浅黄色的Na2O2;振荡后将燃着的木条伸向瓶中 | 第①小组放入少量的Na2O2 | 木条未复燃,固体由 | CO2过量(或Na2O2不足),瓶中O2少CO2多,Na2O2全部发生了反应 |
| 第②小组放入的Na2O2稍多一些 | 木条复燃,部分固体变为白色 | |||
| Ⅱ | 两小组均用手触摸瓶的底部 | 瓶底发热 | ||
| Ⅲ | 两小组都各取少量白色固体于试管中,滴入稀盐酸并塞上带导管的橡胶塞,将产生的气体通入 | 有CO32-存在,说明生成物中有Na2CO3 |
(4)类比推理
Na2O2与H2O反应后应该有NaOH和O2生成。则向包有Na2O2的棉花上滴两滴水,棉花也应剧烈燃烧;向生成的溶液中滴入酚酞应该变红色。
(5)实验与解释
①向小烧杯(底部垫砂)中包有Na2O2的脱脂棉上滴两滴水,发现有气泡产生,杯底发热,但棉花没有燃烧,其原因可能是 ;
②向杯中的溶液滴入酚酞,溶液变红色,振荡后红色消失,其原因可能是 。
(6)联想与启示
保存Na2O2的注意事项为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A是制取CO2的装置.写出A中发生反应的化学方程式:________________________________.
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式:______________________
____________________________________________________________________.
(4)试管F中收集满气体后,下一步实验操作是:____________________________________
________________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中不正确的是( )
A.因为K的活泼性强,所以钾应该保存在煤油中
B.K可以被氧气所氧化,且产物不只有K2O一种
C.K与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气
D.K 可以与水剧烈反应,生成氢气
可以与水剧烈反应,生成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示。请回答:

(1)画出G离子结构示意图________;
(2)写出B、I的化学式B________,I________;
(3)写出H的一种用途_______________________________________________;
(4)写出A受热分解的化学方程式________________________________;
(5)若H与C反应固体增重4.2 g,则参加反应的C气体在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业纯碱中常含有NaCl、Na2SO4等杂质,可用如图所示的装置测定工业纯碱中有效成分的含量。
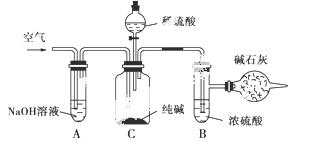
实验过程的主要步骤是:
①准确称取干燥试样x g(x>2),放入广口瓶C中。
②准确称量装有碱石灰的干燥管的质量为y g。
③从分液漏斗中缓缓注入稀硫酸,至不再产生气体为止。
④缓缓鼓入空气数分钟,然后将干燥管取下,准确称其质量为W g。
根据以上实验,填写下列空格:
(1)装置A的作用是__________________,如果不用装置A,会导致实验结果偏________(填“大”、“小”或“不变”,下同)。
(2)装置B的作用是__________________,如果不用装置B,会导致实验结果偏________。
(3)通入空气的作用是______________________________________________________________。
如果不通入空气,会导致实验结果偏________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:
Na+2H2O====Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:
Al+2OH-====Al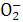 +H2↑
+H2↑
C.金属铝溶于盐酸中:2Al+6H+====2Al3++3H2↑
D.铁跟稀硫酸反应:Fe+2H+====Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:

(1)请用离子方程式表示以上工艺流程中第①步反应:___________________ 。
(2)写出以上工艺流程中第③步反应的化学方程式:_______________________。
(3)金属铝与氧化铁混合点燃,会发生剧烈的反应。该反应的化学方程式为 __
________________________________________________________________。
请举一例该反应的用途______________________________________________。
(4)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,
该电池主要工作原理如右图所示,其正极反应为:ClO- + H2O + 2e- == Cl- + 2OH-,关于该电池的叙述正
确的是
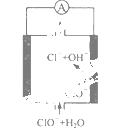 A.该电池中镁为负极,发生还原反应
A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应为:Mg + C lO- + H2O == Mg(OH)2↓+ Cl-
lO- + H2O == Mg(OH)2↓+ Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com