
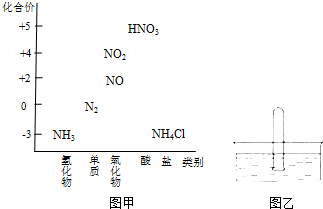
 图甲为氮及其化合物的类别与化合价对应的关系图.
图甲为氮及其化合物的类别与化合价对应的关系图.分析 (1)①实验室用固体氯化铵和固体氢氧化钙反应制备氨气;
②依据氨气的物理性质-密度、水溶性选择收集方法;
③依据氨气极易溶于水的性质解答;
(2)①b.化合价升高的元素体现还原性,氨气催化氧化生成一氧化氮和水,反应中体现氨气的还原性;
②化合价降低的元素体现氧化性,铜与稀硝酸反应生成硝酸铜和一氧化氮和水,反应中硝酸体现强的氧化性;
(3)①二氧化氮和水反应生成硝酸和一氧化氮;
②NO2与水和氧气按一定比例混合,NO2可完全被水吸收生成硝酸.
解答 解:(1)①铵盐和碱反应生成氨气,实验室用固体氯化铵和固体氢氧化钙反应制备氨气,反应的方程式为:Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②氨气极易溶于水,所以只能用排空气的方法收集,又因为氨气密度小于空气密度,所以选择向下排空气法收集,
故答案为:氨气密度比空气轻;
③氨气易溶于水,使装置中的压强小于外界的压强,从而引起倒吸,
故答案为:氨气易溶于水,使装置中的压强小于外界的压强,引起倒吸;
(2)①b.氨气催化氧化生成一氧化氮和水,化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,氨气中-3价N升高为+2价,体现还原性,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
②铜与稀硝酸反应生成硝酸铜和一氧化氮和水,化学方程式:3Cu+8HNO3 (稀)═3Cu(NO3)2+2NO↑+4H2O,硝酸中+5价N降为+2价,体现氧化性,
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)①二氧化氮可以和水之间反应,反应物NO2中N元素化合价降低为+2价,升高为+5价,生成硝酸和一氧化氮,反应为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2NHO3+NO;
②NO2与水和氧气反应生成硝酸,发生反应的方程式为:4NO2+O2+2H2O=4HNO3,所以使试管中NO2完全被水吸收的操作是:向试管中通$\frac{V}{4}$ml入氧气,
故答案为:向试管中通入$\frac{V}{4}$ml氧气.
点评 本题考查氨气的制备原理,氨气的性质,题目难度中等,注意一氧化氮的制备和还原性验证的实验操作分析和实验步骤的设计,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2与CO2完全反应时转移电子数为2NA | |
| B. | 标准状况下11.2 L Cl2与4.25 g NH3所含有的原子数 | |
| C. | 标准状况下36 g H2O与1.204×1024个O2分子所占的体积 | |
| D. | 1mol固体NaHCO3所含有的阴阳离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部可以 | B. | 仅②可以 | C. | 仅⑤可以 | D. | ①②③④可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①②④ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al 和Mg | B. | K和 Na | C. | Na 和Al | D. | Zn 和Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com