
【题目】升高温度,下列数据不一定增大的是
A. 化学反应速率vB. AgCl的溶度积Ksp(AgCl)
C. 化学平衡常数KD. 水的离子积Kw
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】高纯六水氯化锶晶体(SrCl26H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为: 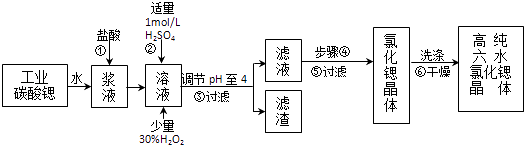
已知:Ⅰ.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①加快反应速率的措施有(写一种).碳酸锶与盐酸反应的离子方程式 .
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+ , 其离子方程式为 .
(3)在步骤②﹣③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为
A.氨水
B.氢氧化锶粉末
C.氢氧化钠
D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是(填化学式).
(5)步骤④的操作是、 .
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃
B.70~80℃
C.80~100℃
D.100℃以上.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1molL﹣1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(1)写出OA段所发生反应的离子方程式、
(2)当加入35mL盐酸时,产生CO2的体积为mL(标准状况).
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数. 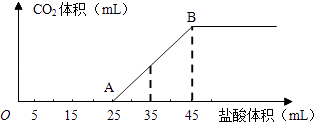
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关.下列叙述正确的是( )
A.明矾具有消毒杀菌作用,可用于净水
B.BaSO4在医学上用做钡餐,Ba2+对人体无毒
C.碳酸氢钠和氢氧化铝均可用于治疗胃酸过多
D.用催化法处理汽车尾气中的CO和NO:CO+NO ![]() C+NO2
C+NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的区分方法不正确的是
A. 用碘酒区分淀粉溶液与蛋白质溶液
B. 用AgNO3溶液区分NaCl与KCl溶液
C. 用澄清石灰水区分CO与CO2气体
D. 用石蕊试液区分稀H2SO4与NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列有关晶体的叙述中错误的是 ( )
A. 离子晶体中,一定存在离子键B. 原子晶体中,只存在共价键
C. 金属晶体的熔沸点均很高D. 稀有气体的原子能形成分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O
试通过计算和推理完成下面的问题:
(1)SO2物质可以使酸性KMnO4溶液褪色,此反应中(填写化学式)失去电子.
(2)足量的铜片与 含溶质1.8mol的浓H2SO4充分反应,如果该反应过程中转移了 0.2mol电子,生成的CuSO4的质量为克,生成的气体在标准状况下体积为升(假设气体全部逸出).
(3)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应.请写出此过程发生的反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HA为酸性略强与醋酸的一元弱酸,在0.1 mol·L-1NaA溶液中,离子浓度关系正确的是
A. c(Na+)>c(A-)>c(H+)>c(OH-)
B. c(Na+)>c(OH-)>c(A-)>c(H+)
C. c(Na+)+c(OH-)=c(A-)+c(H+)
D. c(Na+)+ c(H+) = c(A-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com