
【题目】在容积为2.0L的密闭容器内,物质D在T℃时发生反应。其反应物和生成物的物质的量随时间t的变化关系如下图,据图回答下列问题:
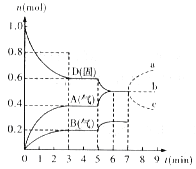
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为___________mol/(Lmin)。(结果保留两位有效数字)
(2)根据右图写出该反应的化学方程式___________。
(3)第5分钟时,升高温度,A、B、D的物质的量变化如图,则该反应是___________(填“放热”或“吸热”)反应,若在第7分钟时增加D的物质的量,A的物质的量变化正确的是___________(用图中a~c的编号回答)。
【答案】(1)0.067;(2)2D![]() 2A+B;(3)吸热,b
2A+B;(3)吸热,b
【解析】
试题分析:(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为 =0.067mol/Lmin,故答案为:0.067;
=0.067mol/Lmin,故答案为:0.067;
(2)根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol,△A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s)![]() 2A(g)+B(g); 故答案为:2D(s)
2A(g)+B(g); 故答案为:2D(s)![]() 2A(g)+B(g)
2A(g)+B(g)
(3)温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应,D为固体,增加D的物质的量,浓度不变,平衡不移动,故选b,故答案为:吸热;b。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
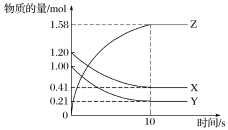
(1)从反应开始到10 s时,用Y表示的反应速率为____________________。
(2)该反应的化学方程式为_______________________。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:
甲:v(X)=0.3 mol·L-1·s-1;
乙:v(Y)=0.12 mol·L-1·s-1
丙:v(Z)=9.6 mol·L-1·min-1;
则甲、乙、丙三个容器中反应速率由慢到快的顺序为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c(NH4+)=c(Cl-) ⑤c(NH4+)<c(Cl-)正确的是( )
A. ①⑤ B. ③④ C. ②⑤ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如下图:
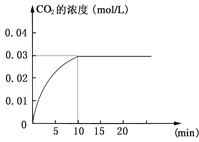
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=____________mol/L,该温度下的平衡常数K= (计算出结果)。
(2)判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的 CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向正反应方向移动,溶液中c(H+)增大
B.加水,平衡向正反应方向移动,c(CH3COO-)和c(H+)增大
C.加入少量HCl,平衡逆向移动,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向逆反应方向移动,溶液导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学对人体健康和人类生活有着十分重要的作用。请回答下列问题:
(1)抗胃酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。请写出NaHCO3、Al(OH)3与胃酸(以HCl表示)作用的化学方程式: 、_____________。某品牌抗酸药的主要成分有糖衣、碳酸氢钠、氢氧化铝、淀粉。写出该抗酸药发挥功效时的离子方程式:___________________、__________________。
(2)甲同学患了夜盲症,可能的原因之一是体内缺少维生素 (A、B、C、D、 E、K,下同);乙同学在刷牙时牙龈经常出血,该同学在平时应多吃富含维生素 的食物。
(3)铝的金属活动性比较强,铝在空气中却比较稳定,其原因是_________________
(4)有一种抗酸药,其有效成分是CaCO3,为测定每一片药片中CaCO3的质量,现取一片药片,研成粉末,再与足量盐酸反应,收集到标准状况下的CO2气体22.4mL.则CaCO3与足量盐酸反应的化学方程式为 ,每一片药片中CaCO3的质量为 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定硫酸铜结晶水合物中结晶水含量的定量实验中,会导致结果偏大的是
A. 未达恒重即停止实验 B. 加热时有晶体溅出
C. 黏在玻璃棒上固体刮入坩埚 D. 固体加热至淡蓝色即停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干空气中稳定,在湿空气中分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
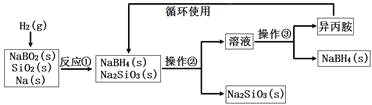
下列说法不正确的是
A.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀
B.操作②、操作③分别是过滤与蒸发结晶
C.反应①加料之前需将反应器加热至100℃以上并通入氩气
D.反应①中氧化剂与还原剂的物质的量之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com