
| A. | 只有①③④ | B. | 只有①⑤ | C. | 只有①③④⑤ | D. | ①②③④⑤ |
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 即使没有物质的变化,也可能有能量的变化 | |
| B. | 稀硫酸和氢氧化钡溶液反应生成1mol水释放的热量即为中和热 | |
| C. | S(g)+O2(g)═SO2(g)△H=a;S(s)+O2(g)═SO2(g)△H=b;则a>b | |
| D. | 燃烧热随化学方程式前的化学计量数的改变而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发使用的主要仪器是蒸发皿、酒精灯、玻璃棒、带铁圈的铁架台 | |
| B. | 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| C. | 丁达尔效应可以鉴别胶体和溶液 | |
| D. | 用规格为10 mL的量筒量取6.20 mL的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图2所示.已知断裂1mol化学键所需的能量(kJ):N≡N为942、O═O为500、N-N为154,则断裂1mol N-H键所需的能量是391kJ.
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图2所示.已知断裂1mol化学键所需的能量(kJ):N≡N为942、O═O为500、N-N为154,则断裂1mol N-H键所需的能量是391kJ.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2与F2反应的热化学方程式为:H2(g)+F2(g)=2HF(g);△H=-541 kJ | |
| B. | 2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于541 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
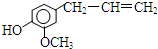 ,该物质不应有的化学性质是( )
,该物质不应有的化学性质是( )| A. | ①③ | B. | ③⑤ | C. | ④⑤ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,第一电离能最小的元素是Cu(填元素符号).
,第一电离能最小的元素是Cu(填元素符号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com