
【题目】对于反应A2(g)+2B2(g)2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是( )
A.
B.
C.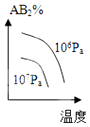
D.
【答案】B
【解析】解:A.T0时为平衡点,升高温度平衡逆向移动,则正反应速率大于逆反应速率,所以不符合勒夏特列原理,故A错误;B.最高点时该反应达到平衡状态,升高温度平衡逆向移动,生成物浓度降低,符合勒夏特列原理,故B正确;
C.该反应的正反应是放热反应,升高温度平衡逆向移动,产物浓度降低;该反应前后气体体积减小,增大压强平衡正向移动,生成物含量增大,不符合勒夏特列原理,故C错误;
D.增大压强平衡正向移动,生成物浓度升高;升高温度平衡逆向移动,生成物浓度降低,故D错误;
故选B.
【考点精析】利用化学平衡移动原理以及影响因素对题目进行判断即可得到答案,需要熟知影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动.


科目:高中化学 来源: 题型:
【题目】将10mL2mol/L的HCl溶液稀释到200mL,从中取出5mL,这5mL溶液的物质的量浓度为
A.0.5mol/LB.0.25mol/LC.0.1mol/LD.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
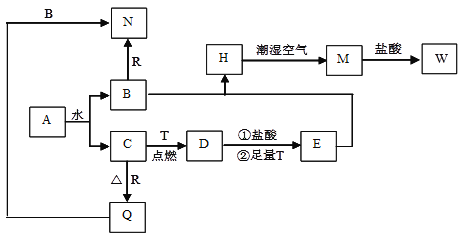
(1)写出下列物质的化学式A_______;D__________;N________。
(2)按要求写下列反应方程式:检验w中阳离子的离子方程式__________________________。
H在潮湿空气中变成M的化学方程式_________________________________。
D与盐酸反应的离子方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:
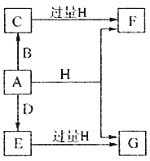
(1)A所含元素在周期表中的位置为______________,C的电子式为_______________。
(2)A与H在加热条件下反应的化学方程式为__________________。
(3)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为____________________。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为__________________。
(4)向含有0.4molF、0.1molG的混合溶液中加入过量盐酸,完全反应后收集到aL气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a=____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com