
【题目】FeCl3为黑棕色固体,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解。
(1)甲组同学拟用下列装置制取纯净干燥的氯气。
①装置B的作用是_________
②装置A中发生反应时消耗的氧化剂和还原剂的物质的量之比为__________
(2)乙组同学选用甲组实验中的装置ABC和下列装置制取FeCl3

①乙组同学的实验装置中,依次连接的合理顺序为:a→_____→_____→_____→_____→_____→_____
②连好装置,检查装置的气密性,先打开装置A中___________(填仪器的名称)的活塞,直到______再点燃装置F处的酒精灯,目的是_______
③装置D的作用有_______
(3)实验结束后,取少量F中的固体加水溶解,欲对所得产物FeCl3中是否含有FeCl2进行检测,所需试剂是_______
a.KSCN b.H2O2 c.K3[Fe(CN)6] d. .K4[Fe(CN)6]
经检测发现溶液中含有Fe2+,丙同学认为所得产物FeCl3中一定含有FeCl2,丁同学认为不一定,理由是_____
【答案】吸收多余的HCl 1:5 f g d e b c 分液漏斗 装置中充满黄绿色的气体 排尽装置内的空气 吸收多余的氯气和防止空气中的水蒸气进入装置 c FeCl3与过量的铁粉反应生成FeCl2,所以不一定含有FeCl2
【解析】
(1)①制取的氯气中混有HCl和水蒸气,先通入饱和食盐水中除去氯化氢,再通入浓硫酸吸收水蒸气,则装置B应盛放饱和食盐水,吸收多余的HCl;
②该实验用KMnO4与浓盐酸反应制取氯气,写出反应的离子方程式,从而判断氧化剂和还原剂的物质的量之比;
(2)①利用装置ABC可以制取干燥纯净的氯气,氯气通入F装置中与铁粉加热反应生成氯化铁,再连接E装置,冰水浴收集升华的氯化铁,再连接D装置,碱石灰吸收多余的氯气,并阻止空气中的水蒸气进入E装置,据此将导管口进行连接;
②连好装置,检查装置的气密性,先打开装置A中分液漏斗的活塞,KMnO4与浓盐酸开始反应生成氯气,用氯气排尽装置内的空气,防止铁与氧气反应,直到装置中充满黄绿色的气体,再点燃装置F处的酒精灯;
③根据已知信息无水氯化铁遇潮湿空气极易潮解,并防止多余氯气进入空气从而分析装置D的作用;
(3)根据亚铁离子的检验选择试剂;根据FeCl3与铁粉可反应生成FeCl2分析原因。
(1)①制取的氯气中混有HCl和水蒸气,先通入饱和食盐水中除去氯化氢,再通入浓硫酸吸收水蒸气,则装置B应盛放饱和食盐水,吸收吸收多余的HCl;
故答案为:吸收多余的HCl;
②该实验用KMnO4与浓盐酸反应制取氯气,装置A中发生反应的离子方程式为:2MnO4-+10Cl- +16H+=2Mn2++5Cl2↑+8H2O,KMnO4为氧化剂,Cl- 为还原剂,则消耗的氧化剂和还原剂的物质的量之比为1:5;
故答案为:1:5;
(2)①利用装置ABC可以制取干燥纯净的氯气,氯气通入F装置中与铁粉加热反应生成氯化铁,再连接E装置,冰水浴收集升华的氯化铁,再连接D装置,碱石灰吸收多余的氯气,并阻止空气中的水蒸气进入E装置,则导管口依次连接的合理顺序为:a→f→g→d→e→b→c;
故答案为:f;g;d;e;b;c;
②连好装置,检查装置的气密性,先打开装置A中分液漏斗的活塞,KMnO4与浓盐酸开始反应生成氯气,用氯气排尽装置内的空气,防止铁与氧气反应,直到装置中充满黄绿色的气体,再点燃装置F处的酒精灯;
故答案为:分液漏斗;装置中充满黄绿色的气体;排尽装置内的空气;
③装置D盛放碱石灰,可用于吸收多余的氯气和防止空气中的水蒸气进入装置,防止FeCl3潮解;
故答案为:吸收多余的氯气和防止空气中的水蒸气进入装置;
(3)FeCl3、FeCl2同时存在时,检验Fe2+用K3[Fe(CN)6]溶液,现象为有蓝色沉淀生成;
由于FeCl3与过量的铁粉反应生成FeCl2,所以不一定含有FeCl2;
故答案为:c;FeCl3与过量的铁粉反应生成FeCl2,所以不一定含有FeCl2。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为-285.8kJ·mol-1
B. 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
C. 在101k Pa时,1mol C与适量O2反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ·mol-1
D. 在稀溶液中,H+(aq)+OH-(aq)=H2O(l),![]() H=-57.3 kJ·mol-1。若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ
H=-57.3 kJ·mol-1。若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁烯与氯化氢可能发生的两种加成反应及相应的能量变化与反应过程如下图所示,下列说法错误的是( )


A.活化能:反应①大于反应②
B.中间产物的稳定性:中间体1小于中间体2
C.产物的能量:产物1大于产物2
D.△H大小:反应①小于反应②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镁在点燃条件下与二氧化碳反应:2Mg+CO2![]() 2MgO+C。当0.4mol Mg与0.1mol CO2充分反应后,物质的种类及其数量正确的是( )
2MgO+C。当0.4mol Mg与0.1mol CO2充分反应后,物质的种类及其数量正确的是( )
A.0.2 mol MgO + 0.1 molC
B.0.4 mol MgO + 0.2 molC
C.0.3 mol Mg + 0.2 mol MgO +0.1mol C
D.0.2 mol Mg + 0.2 mol MgO+0.1 molC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,氯水中部分含氯的物质的量浓度分数(某物质的物质的量浓度占各物质的量浓度之和的百分数)与pH的关系如图所示。下列叙述正确的是( )
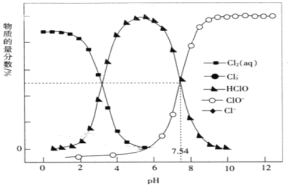
A.pH=1的新制氯水中,c(Cl2)>c(ClO-)>c(HClO)
B.随着pH增大,溶液颜色不断加深
C.pH>10时,溶液中含氯微粒主要为ClO-和Cl-
D.pH=4的氯水中加入NaOH溶液,只发生离子反应HClO+OH-=ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molA气体和1molB气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为______。
(2)若反应经2min达到平衡,平衡时C的浓度______0.8mol/(填大于,小于或等于”)
(3)若已知达平衡时,该容器内混合气体总压强为P,混合气体起始压强为P0.请用P0、P来表示达平衡时反应物A的转化率a(A)为______%
(4)能够说明该反应达到平衡的标志是__________。
A .容器内混合气体的密度保持不变
B. v(A)=3v(B)
C .A、B的浓度之比为3:1
D .单位时间内消耗3n molA的同时生成n molB
E.体系的温度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )

A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL则该R摩尔质量为___。
(2)已知CO、SO2的混合气体质量共18.4g,标准状况下体积为8.96L,则可推知该混合气体中CO的物质的量分数为____,混合气体的平均相对分子质量为____。
(3)同温同压下,SO2与氢气的密度之比为____;若体积相同时,两种气体的质量比为____。
(4)质量比为51∶28的NH3、CO所含质子数之比为____。
(5)标准状况下,aL气体X2和bL气体Y2恰好完全反应生成cL气体Z,若2a=6b=3c,则Z的化学式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:

请回答下列问题:
(1)实验室只有100mL、250mL、500mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需量取该浓硫酸______mL。
(2)接下来完成此实验你将用到的仪器有20mL量筒、烧杯、玻璃棒、胶头滴管、____________。
(3)使用容量瓶前必须进行的一步操作是____________。
(4)要从所配溶液中取出10 mL稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(5)下列操作会使所配溶液浓度偏低的是__________。
A. 用量筒量取浓硫酸,读数时仰视刻度线
B. 转移溶液时未洗涤烧杯
C. 定容时俯视容量瓶的刻度线
D. 定容摇匀后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com