
| A. | M+ | B. | HA- | C. | A2- | D. | M+和HA- |
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2的质量只有在标准状况下才约为2g | |
| B. | 在标准状况下某气体的体积是22.4L,可认为该气体的物质的量约是1mol | |
| C. | 在20℃时,1mol任何气体的体积总比22.4L大 | |
| D. | 1mol H2和O2的混合气体的质量可能为34g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4mol | B. | 5mol | C. | 6mol | D. | 7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 氯气长时间放置后酸性减弱 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
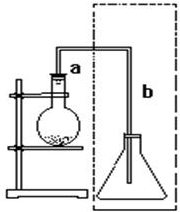 如图是实验室制取溴苯的装置,说明:
如图是实验室制取溴苯的装置,说明:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
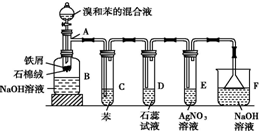 (1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.
(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com